成人朗格汉斯细胞组织细胞增生症的治疗进展
2023年1月
中华内科杂志,第62卷第1期 第97页-第102页
戴佳雯,曹欣欣
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis, LCH)是一种罕见的组织细胞肿瘤,由朗格汉斯细胞样组织细胞在全身各组织中浸润从而产生一系列脏器损害。LCH根据受累部位不同分为单系统受累(single system LCH, SS-LCH)和多系统受累(multiple system LCH, MS-LCH),SS-LCH又根据病灶数量分为单系统单病灶(SS-s)和单系统多病灶(SS-m)。LCH可累及全身各个系统,常见受累部位为骨(50%~70%)、肺(30%~60%)、内分泌(20%~50%)及皮肤(20%~40%)[1],有肝、脾及骨髓受累的LCH被称为高危LCH(risk organ+-LCH, RO+-LCH),患者可有骨痛、皮疹、呼吸困难、尿崩、生长发育异常、听力下降等各种非特异性临床表现。2010年有研究报道在57%的LCH患者中发现了丝裂原活化蛋白激酶(MAPK)途径中存在BRAFV600E突变[2],为确定LCH是一种肿瘤性疾病提供了重要线索。BRAF蛋白是RAF家族的成员,是MAPK信号通路的关键组成部分。后续研究发现,LCH中存在MAPK通路持续激活。目前发现MAPK通路中突变频率最高的是BRAFV600E(64%),其次是BRAFindel(29%,其中BRAFN486_P490del最常见)和MAP2K1(19%,其中MAP2K1E102_I103del最常见),其他少见突变还包括BRAF融合、ARAF、ERBB3等[2, 3, 4, 5]。此外,调节细胞周期的PI3K通路(PI3K-AKT-mTOR)突变(如PIK3CA突变)和髓系相关基因突变(如ALK、TET2、JAK2、KRAS突变等)也有报道[5, 6, 7]。目前认为LCH是一种以MAPK信号通路激活为主要特征的克隆性血液系统肿瘤,属于炎性髓系肿瘤。
根据受累部位不同,成人LCH的治疗方式也不同,目前尚无推荐的标准治疗模式。大部分孤立性病灶可采用局部治疗,而SS-m及MS-LCH患者往往需要进行系统治疗。原发性肺LCH(pulmonary LCH, PLCH)与吸烟密切相关,大部分患者在戒烟后肺部病变可逐渐缓解。本文就成人LCH中的具体分型SS-s、PLCH、SS-m及MS-LCH的治疗进展予以综述。
皮肤、骨、淋巴结及胃肠道息肉等病灶可直接通过诊断性活检或手术切除。对于外阴、大面积的皮肤受累、重要骨性结构等不适合手术切除的部位,可采用局部治疗。皮肤病灶可局部外用氮芥或咪喹莫特、口服药如低剂量甲氨蝶呤、羟基脲、沙利度胺、聚乙二醇化干扰素-α及光学治疗[8]。不适宜切除的骨病灶可考虑行局部放疗(常用剂量为10~20 Gy)[9]。口服药物方面,羟基脲±甲氨蝶呤对复发难治性皮肤或骨病变有效。双磷酸盐可有效缓解骨痛、促进恢复。最近有研究报道,吲哚美辛作为一线或二线用药治疗LCH骨受累患者的总体有效率为98%,仅17%的患者出现复发[10],但考虑到LCH的本质是肿瘤性疾病,吲哚美辛的长期疗效有待进一步证实。乳突、蝶骨、眶骨、斜坡和颞骨被称为中枢神经系统高风险部位(central nervous system-risk, CNS-risk),这些部位受累的患者更易进展至中枢性尿崩症(diabetes insipidus, DI)和神经退行性LCH(neurodegenerative-LCH, ND-LCH)[11]。对于中枢高风险骨病变和复发/难治性SS-LCH,通常需采用系统治疗。
与其他单灶性病变不同,成人原发性PLCH与吸烟有很大关系,部分患者通过戒烟就能达到疾病缓解[12]。因此,戒烟应该是PLCH初始治疗的重中之重。存在喘息和阻塞性肺疾病的患者可联合吸入糖皮质类固醇和支气管扩张剂。对于非吸烟者或戒烟后临床症状仍进行性加重的患者,应选择系统治疗。多个回顾性研究证实,克拉屈滨可改善肺功能、缓解肺结节及囊性变,并用于晚期PLCH的挽救治疗[13, 14],而长春碱类药物[15]和放疗对肺PLCH效果不佳[16]。反复发作气胸的患者通常需要胸膜固定术。晚期出现肺高压的患者可考虑使用血管扩张剂如内皮素受体拮抗剂、磷酸二酯酶5抑制剂等。终末期患者应考虑肺移植,据报道移植后的1年生存率>75%,但移植后仍可有疾病复发[17]。其他辅助治疗包括氧疗、接种流感疫苗及时控制肺部感染等。
SS-m及MS-LCH患者往往需要进行系统治疗,但由于成人LCH的发病率低、诊治困难,目前尚未有推荐治疗共识,主要的治疗选择包括化疗、免疫调节治疗、靶向治疗及移植治疗。
1.化疗:目前主要有两大类化疗方案,一类是基于长春碱+泼尼松(VP)的联合化疗,另一类是基于核苷类似物的单药或联合抗细胞增殖治疗,主要用药包括阿糖胞苷、克拉屈滨及氯法拉滨。近年来发表的较大型成人队列研究总结见
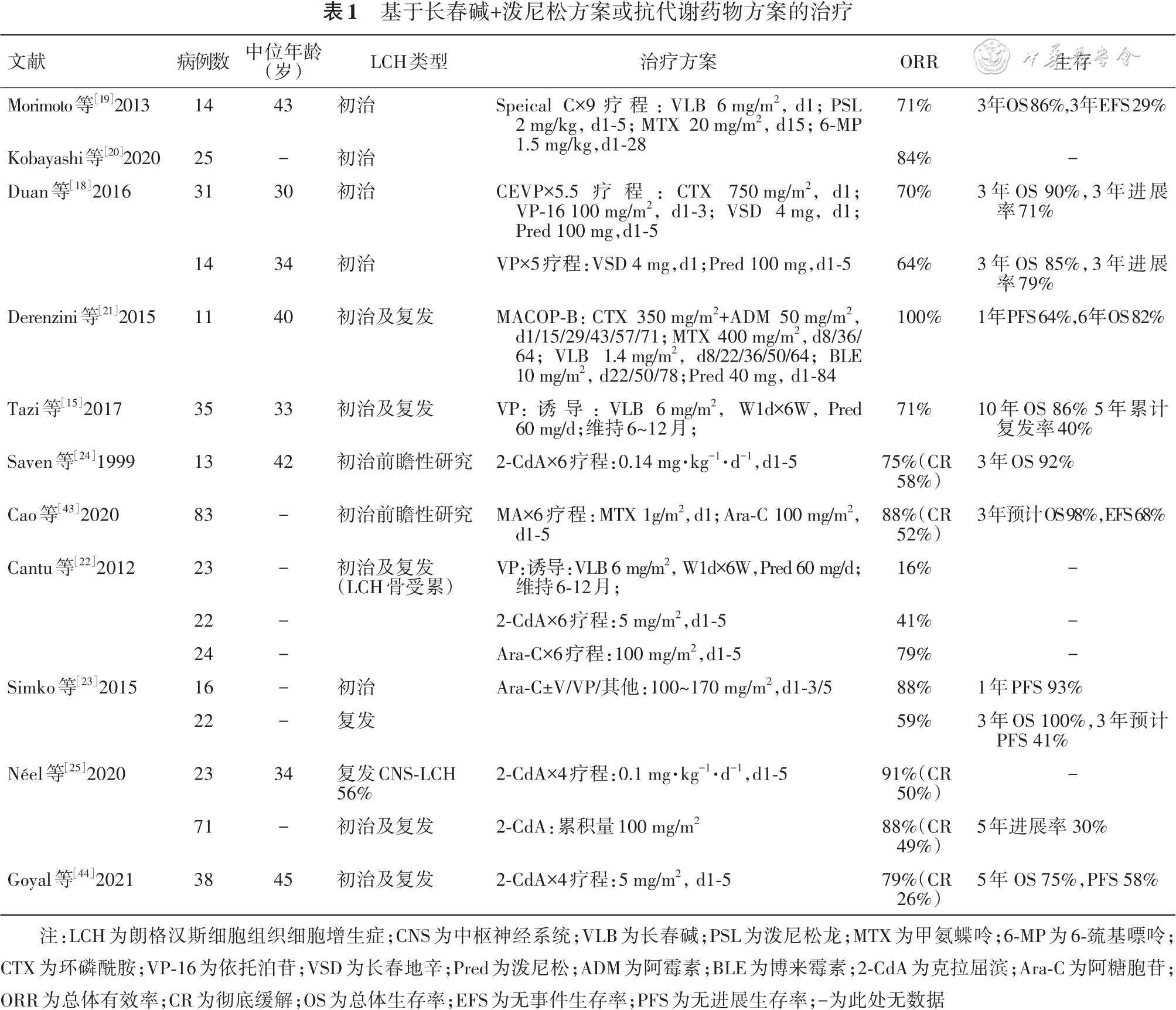
目前大部分基于VP的治疗都借鉴了儿童LCH的标准一线化疗方案。成人VP方案治疗的总体有效率(overall response rate, ORR)为70%~80%,3年进展率为30%~40%,2级以上治疗相关不良事件(adverse event, AE)为30%~50%,主要AE是周围神经病变和骨髓抑制。在VP基础上联合多药治疗可进一步增加有效率,减少复发,但血液学毒性的发生率随之增加。我中心进行了CEVP对比VP治疗成人LCH的回顾性研究,发现两种方案的有效率(70%比64%)及3年复发率(71.0%比78.6%)相似,但CEVP方案中性粒细胞减少的发生率明显更高(48%比7%)[18]。日本LCH协会提出了适用于门诊患者的Special C方案[19, 20],最新数据显示ORR为83%,复发率为24%。目前VP联合多药治疗方案中缓解率最高的为Derenzini等[21]提出的MACOP-B方案,ORR为100%,治疗反应持久,在诱导结束后无须维持治疗。但它需连续3个月每周静脉注射化疗药物,给药方式复杂,且近一半的患者出现3级及以上AE。
2012年Cantu等[22]的回顾性研究发现,对LCH多灶性骨受累患者,相比于阿糖胞苷或克拉屈滨,VP方案的缓解率更低、治疗毒性更高,84%的患者治疗无效或1年内复发,75%的患者出现了3~4级周围神经病,而阿糖胞苷治疗无效或1年复发率仅为21%,克拉屈滨为59%。2017年Tazi等[15]的回顾性研究发现,接受VP治疗后,肺功能受损的患者无1例好转。考虑到VP方案在成人LCH患者中的有效率相对较低、治疗毒性相对更高,一些专家逐渐倾向于使用抗代谢药物阿糖胞苷、克拉屈滨等作为成人LCH的一线治疗。
阿糖胞苷:2012年,Cantu等[22]报道阿糖胞苷在治疗LCH骨病变的有效率远高于VP或克拉屈滨,ORR达80%。随后,Simko等[23]的回顾性研究指出, 阿糖胞苷治疗初治LCH患者的ORR为88%,1年无进展生存率(progression-free survival, PFS)为93%。复发患者中有超过50%的患者在治疗的前3个月获得缓解,其中超过50%的高危患者获得了缓解,3年预计PFS 41%,提示阿糖胞苷反应速度快,缓解程度深。唯一的前瞻性研究来自我中心研究团队,该研究采用甲氨蝶呤+阿糖胞苷(MA)方案治疗83例初治LCH患者,ORR为88%,3年进展率为32%,证实阿糖胞苷治疗效果确切,但此方案中3~4级血液学毒性的发生率较高,近一半的患者出现了粒缺发热。
克拉屈滨:1999年Saven和Burian [24]的前瞻性研究发现单药克拉屈滨治疗初治低危LCH的ORR 为75%,超过一半的患者实现完全缓解(complete response, CR)。Néel等[25]回顾了71例接受克拉屈滨治疗的患者,ORR为88%,一半的患者CR,大部分中枢神经系统受累患者达到了缓解,5年PFS为30%,提示克拉屈滨单药治疗有效率高,并且可获得疾病的长期缓解。该研究还发现,未达到CR的患者更易出现复发。Goyal的研究也报道了类似结果。此外,多篇文献报道,克拉屈滨对复发/难治性PLCH有着很大优势。
复发/难治性LCH(relapsed/refractory-LCH, R/R-LCH):对阿糖胞苷或克拉屈滨无反应的R/R-LCH是治疗的一个难点,目前尚无大型的成人队列研究,基于复发/难治性儿童LCH的研究报道总结见

LCH中枢神经系统受累:中枢神经系统受累患者的治疗是另一大难点。中枢神经系统受累可表现为3种形式:(1)由于下丘脑-垂体病变而导致的中枢性尿崩症及其他内分泌异常,这类激素缺乏需要终生内分泌替代治疗;(2)由于占位性病变而导致的头痛、癫痫等,这类局灶性病变可采用化疗或放疗;(3)部分患者在起病数年后会缓慢进展至中枢神经退行性变,产生共济失调、构音障碍、学习困难等症状,因此需要对LCH患者进行长期的随访和监测。ND-LCH在儿童LCH中的发生率可高达25%[30],而在成人队列中相对罕见。考虑到血脑屏障通透性,目前中枢受累的首选治疗为阿糖胞苷或克拉屈滨[31],也有文献指出阿糖胞苷±甲氨蝶呤治疗可部分缓解ND-LCH的临床症状[32]。少量儿童案例报道了早期使用全反式维甲酸(ATRA)[33]、静脉输注大剂量丙种球蛋白(IVIG)[34]或可预防ND-LCH,但其真实有效性仍需大量临床研究进行进一步验证。
对SS-m或MS-LCH患者,推荐阿糖胞苷或克拉屈滨作为一线化疗方案,R/R-LCH可考虑选择氯法拉滨作为挽救性治疗。
2.免疫调节剂:沙利度胺是一种肿瘤坏死因子(TNF)α拮抗剂,已被报道可快速缓解LCH的皮肤受累、骨受累甚至中枢性尿崩症状,但停药后常导致疾病复发。一项前瞻性临床研究发现沙利度胺治疗低危LCH患者的ORR为70%,但高危LCH患者无一获益,主要治疗相关AE为周围神经病变及骨髓抑制[8]。来那度胺总体的有效性和安全性优于沙利度胺。有研究报道来那度胺联合地塞米松、依托泊苷作为4线方案诱导缓解成人复发/难治性MS-LCH的成功案例[35]。4例儿童患者接受了来那度胺联合地塞米松的挽救性治疗,无一发生显著治疗相关AE,且所有患者都达到了持续1年以上的CR[36]。
3.靶向治疗:BRAF抑制剂。近几年陆续报道了vemurafenib或dabrafenib治疗R/R-LCH的成功案例[37, 38, 39, 40]。一项2期临床试验(VE-BASKET)报道了26例接受维莫非尼治疗的非朗格汉斯细胞组织细胞增多症(Erdheim-Chester disease, ECD)和LCH患者(ECD 22例,LCH 4例),2年PFS为86%,OS为96%,没有患者在最佳反应点出现疾病进展,且LCH的疗效优于ECD。BRAF抑制剂具有诱导缓解速度快、缓解程度深的优势,可能成为需要快速逆转器官损害的患者的首选治疗方法,但停药几乎总是导致疾病复发。常见的不良反应包括关节痛、皮疹、疲劳、脱发、QT 间期延长、皮肤乳头状瘤等,31%的患者因不良反应最终停药,其中1例患者发生了治疗相关甲状腺乳头状癌。在vemurafenib治疗黑色素瘤的患者中也报道了继发性皮肤鳞状细胞癌、胰腺导管腺癌的发生。因此,BRAF抑制剂的安全性还需要进一步评估。
丝裂原活化细胞外信号调节激酶(MEK)抑制剂:BRAF野生型患者中MAP2K1突变的发生率达50%,对于存在MAP2K1突变的患者可使用MEK抑制剂cobimetinib或trametinib治疗。有文献报道,BRAF的部分框内缺失性突变(如BRAF p.N486_P490del)对BRAF抑制剂耐药,而对MEK抑制剂敏感[41]。
酪氨酸激酶(TK)抑制剂:酪氨酸激酶抑制剂imatinib也曾用于治疗LCH,但也有失败的案例报道,目前TKI不作为LCH靶向治疗的首选。
4.造血干细胞移植(hematopoietic stem cell transplantation, HSCT):对于高危的、BRAF野生型的MS-LCH患者,可尝试HSCT。目前大部分HSCT的临床经验来自儿童队列。Veys等[42]回顾了1990—2013年接受异基因造血干细胞移植(Allo-HSCT)的87例高危LCH患者(大部分为儿童),发现在2000年之前大多数患者接受了清髓性的HSCT,但存活率较低(25%),移植相关病死率达55%。2000年后更多患者接受了减低预处理强度的HSCT,73%的患者存活,但清髓与减低预处理强度方案的3年存活率相似,减低预处理强度治疗后复发率更高(28%比8%),大多数移植后复发的患者可以通过进一步的化疗挽救。近年来也有成人LCH进行Allo-HSCT和自体造血干细胞移植的个案报道,但自体造血干细胞移植后出现了复发。目前认为HSCT可能是复发难治/高危LCH的有效治疗方法,但HSCT预处理的最佳选择仍不确定。随着新型靶向药物逐渐投入使用,HSCT在R/R-LCH中的地位或许会逐渐下降。
成人LCH是一种发病率极低、临床表现多样的组织细胞肿瘤,成人LCH暂无推荐的一线治疗共识。对于单系统单病灶受累的患者可采用局部治疗,对于单系统多灶性受累或多系统受累的患者推荐系统治疗。化疗方案方面,目前主要有基于VP和基于抗代谢药物两大类。单药阿糖胞苷或克拉屈滨从疗效和副作用方面总体优于VP方案。R/R-LCH可尝试氯法拉滨、新型靶向药物或HSCT治疗。新型靶向药物BRAF抑制剂、MEK抑制剂具有缓解率高、缓解速度快、缓解程度深的优势,但停药普遍复发,且第二肿瘤的副作用无法忽视,未来还需更多的临床试验对其有效性、安全性进行评估。未来还有许多治疗难点有待进一步研究,如高危患者的一线治疗、ND-LCH的预防性治疗、靶向抑制剂的远期预后和风险等问题。
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9]
[10]
[11]
[12]
[13]
[14]
[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
[23]
[24]
[25]
[26]
[27]
[28]
[29]
[30]
[31]
[32]
[33]
[34]
[35]
[36]
[37]
[38]
[39]
[40]
[41]
[42]
[43]
[44]
