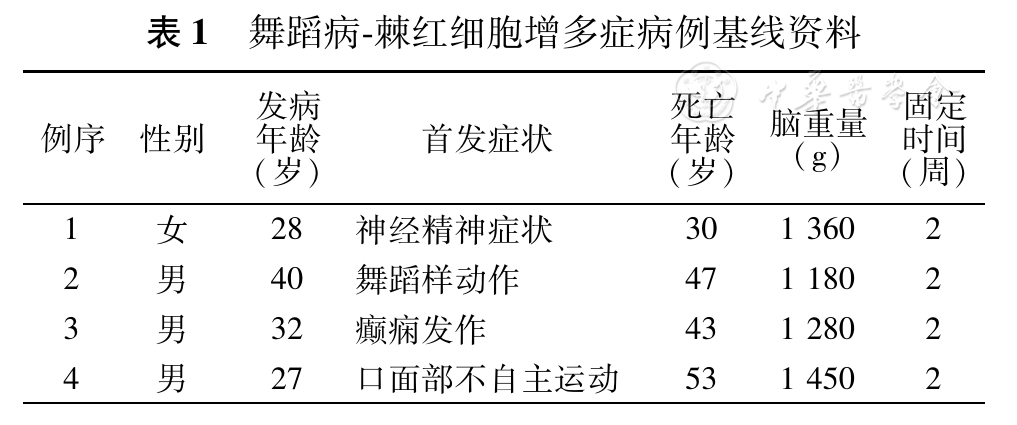
舞蹈病-棘红细胞增多症的纹状体神经生化研究
2016年11月
中华神经科杂志,第49卷第11期 第852页-第855页
刘佳,王鲁宁,朱明伟
舞蹈病-棘红细胞增多症(chorea-acanthocytosis)是一种罕见的常染色体隐性遗传性神经退行性疾病,隶属于神经棘红细胞增多症(neuroacanthocytosis)的范畴。临床上主要表现为口面部不自主运动、肢体舞蹈症以及肌张力障碍、抽动症、帕金森综合征等锥体外系症状[1,2]。构音障碍,进食困难,步态不稳,唇、舌自咬伤,癫痫,痴呆和神经精神症状,以及血清肌酸激酶增高较为常见。鉴于其临床表现和亨廷顿病高度相似,我国神经科医师主要依据典型临床表现,以及外周血棘红细胞计数大于3%诊断该病[3]。基因诊断是"金标准" [4,5]。
舞蹈病-棘红细胞增多症的主要病理改变为基底节区萎缩,其中以尾状核最为明显,壳核、苍白球和黑质也有不同程度的萎缩。病变部位神经元缺失明显,同时伴有星形状胶质细胞增生和小胶质细胞活化。此外,大脑皮质、丘脑、脑干和小脑也有不同程度的病变[6]。其中基底节区纹状体γ-氨基丁酸能多棘神经元功能减退与舞蹈样动作有关。一般认为,与纹状体运动调节通路有关的神经递质主要包括脑啡肽和P物质。脑啡肽主要投射到苍白球外侧段构成间接通路(抑制性通路),而P物质主要投射到苍白球内侧段构成直接通路(易化性通路),通过基底节环路兴奋或抑制运动系统[7]。
近年来发现,亨廷顿病主要影响脑啡肽神经通路。因此,易化性通路占有绝对优势,临床上主要表现为运动过度。脑内的γ-氨基丁酸是由谷氨酸脱羧而成的。γ-氨基丁酸合成酶即为谷氨酸脱羧酶,主要以游离的形式存在于轴突末梢的胞质内。亨廷顿病脑内基底节区纹状体谷氨酸脱羧酶显著减少[8]。Calbindin-D28k是一种钙结合蛋白,主要分布于神经元胞质,以及一些特殊神经元的轴突、树突和细胞核;在维持细胞内游离钙水平、保持钙稳态上发挥关键的作用。研究表明Calbindin-D28k多巴胺能神经元过量表达能促进细胞分化和轴突生长、增加细胞对变性退化的抵抗力[9]。
由于舞蹈病-棘红细胞增多症较为罕见,目前尚缺乏研究系统阐述其神经生化病理学特征。我们通过基因确诊舞蹈病-棘红细胞增多症的尸检病例,探讨纹状体脑啡肽、P物质、谷氨酸脱羧酶和Calbindin-D28k的病理变化及其临床意义。
我们从德国慕尼黑大学神经病理所脑库(欧洲脑库总部)尸检脑标本中,选取基因确诊的舞蹈病-棘红细胞增多症4例(
将脑组织充分固定后,右侧大脑半球按照欧洲脑库标准(1 cm厚度)冠状位切脑[10]。选取伏隔核平面(前纹状体)和苍白球平面(后纹状体)的脑组织,分别从尾状核、壳核和苍白球取材,并按标准化流程制备蜡块。按4 μm厚度制作石蜡切片,使用Ventana BenchMark(罗氏公司,美国)自动免疫组织化学染色仪,分别行脑啡肽、P物质、谷氨酸脱羧酶和Calbindin-D28k染色。石蜡切片脱蜡、水化、自来水冲洗。根据第一抗体要求(脑啡肽抗体稀释至1∶1 000;P物质抗体稀释至1∶50;谷氨酸脱羧酶抗体稀释至1∶200; Calbindin-D28k抗体稀释至1∶100)对组织进行相应的抗原修复,步骤参照试剂盒说明书。染色过程中设阳性和阴性对照。阳性对照用已知阳性切片,阴性对照用PBS代替一抗。
前纹状体可以划分为背侧部(壳核和尾状核的背侧部)和腹侧部(壳核和尾状核的腹侧部以及伏隔核)[11]。免疫组织化学的大体图像由尼康D800E单反相机(配有50 mm镜头)拍摄。对于后纹状体免疫组织化学阳性的终末(即下行投射纤维轴突终末)像素单位的定量分析,我们将每一个苍白球段分割为6个区域,即背外侧部、背内侧部、中间外侧部、中间内侧部、腹外侧部和腹内侧部[12]。在显微镜下(×200倍),随机从上述各区域内拍摄图像1张,使用ImageJ 1.45 s软件行图像分析[8]。最后,计算每个病例苍白球段6个区域的均值做统计学分析。为了防止图像分析中的偏倚,对免疫组织化学结果进行双盲阅片。
采用SPSS 13.0软件包进行统计学分析。阳性终末像素单位所占百分比用中位数(四分位数间距)表示,组间比较应用Mann-Whitney U检验。P<0.05表示差异有统计学意义。
与正常对照和亨廷顿病相比,壳核和尾状核的背侧部脑啡肽、P物质染色和谷氨酸脱羧酶染色在舞蹈病-棘红细胞增多症明显减低;而在壳核和尾状核的腹侧部以及伏隔核受到影响不显著。与此同时,Calbindin-D28k染色在壳核和尾状核的背侧部明显增加(

与正常对照相比,舞蹈病-棘红细胞增多症苍白球外侧段脑啡肽染色阳性终末像素单位所占百分比显著减低[16%(4%)、20%(1%),Z=-2.337, P=0.029];苍白球内侧段P物质染色阳性终末像素单位所占百分比显著减低[12%(3%)、21.5%(1%),Z=-2.352, P=0.029)。同时,舞蹈病-棘红细胞增多症苍白球内侧段谷氨酸脱羧酶染色阳性终末像素单位所占百分比显著减低[25%(11%)、33%(4%),Z=-2.323, P=0.029];而外侧段谷氨酸脱羧酶染色阳性终末像素单位所占百分比减低不显著[22%(12%)、30%(3%),Z=-2.021, P=0.057;
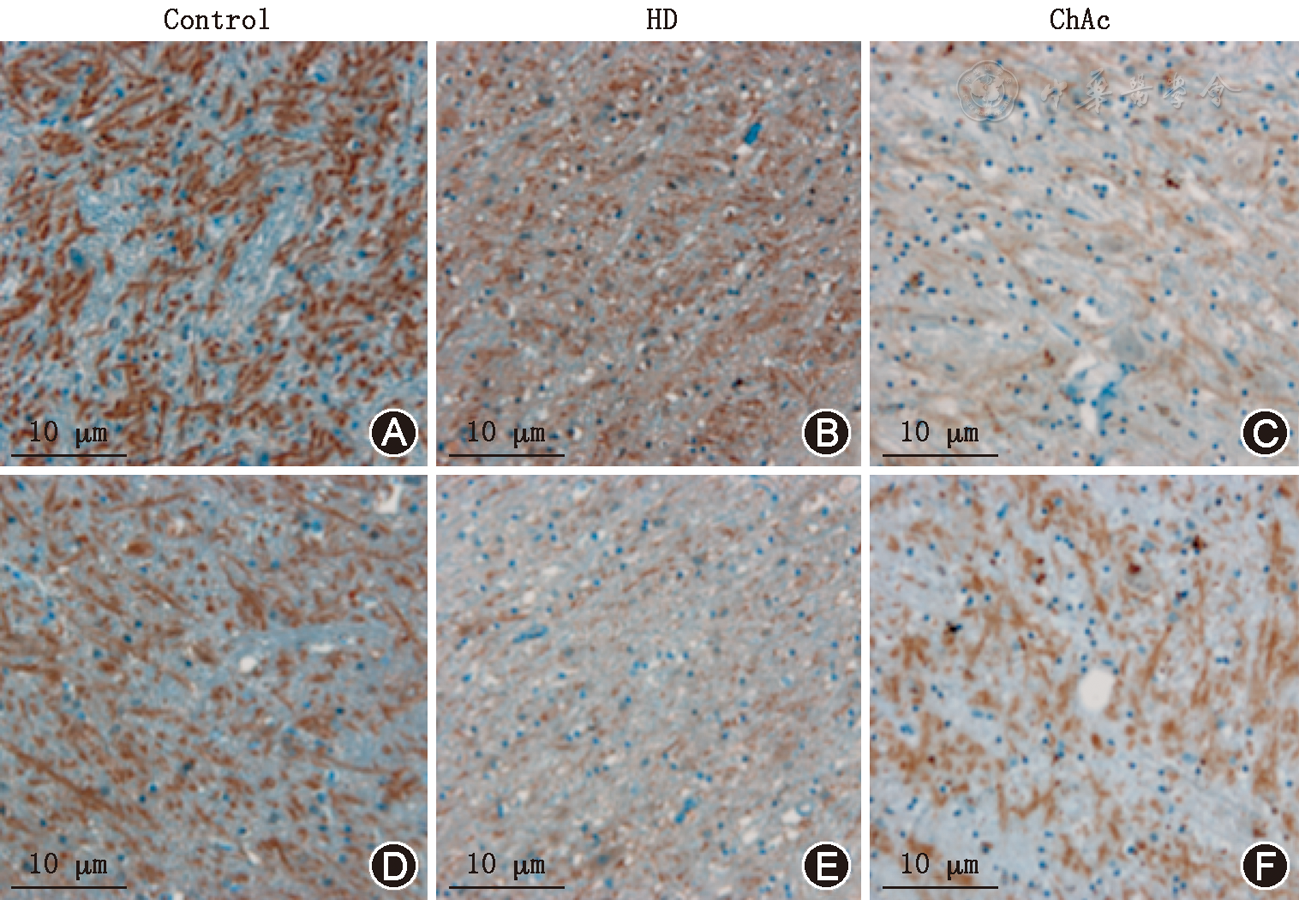
与亨廷顿病相比,舞蹈病-棘红细胞增多症患者苍白球外侧段脑啡肽和谷氨酸脱羧酶染色,以及苍白球内侧段P物质和谷氨酸脱羧酶染色阳性终末像素单位所占百分比差异均无统计学意义。
正常情况下,在基底节直接通路(易化性通路)上,兴奋性皮质传出刺激从纹状体投射到黑质网状部和苍白球内侧段,导致丘脑底核处于兴奋状态,并向皮质反馈大量的兴奋冲动。在基底节间接通路(抑制性通路)上,兴奋性的皮质输出刺激经纹状体投射到苍白球外侧段,从而抑制丘脑底核活性。这一通路主要用于抑制不适当的运动行为。既往研究表明,间接通路(抑制性通路)在亨廷顿病中比直接通路(易化性通路)受累早并且程度严重。可能是参与运动过度的病理机制之一[8,13]。
我们发现舞蹈病-棘红细胞增多症的苍白球外侧段脑啡肽和苍白球内侧段P物质均显著减低,但与亨廷顿病相比差异均无统计学意义。这说明基底节的直接通路(易化性通路)和间接通路(抑制性通路)在舞蹈病-棘红细胞增多症均受到影响。早前个案病例报告曾阐述:舞蹈病-棘红细胞增多症前纹状体P物质染色阳性的神经元比例显著减少,其程度远甚于脑啡肽染色阳性的神经元[6]。而与亨廷顿病对比,后纹状体P物质和脑啡肽染色在舞蹈病-棘红细胞增多症均显著减低[12]。遗憾的是,两个研究均为单个病例非定量研究。
脑内的γ-氨基丁酸是由谷氨酸脱羧而成的。生化研究表明谷氨酸脱羧酶活性在亨廷顿病降低[14]。在正常尾状核和壳核中,谷氨酸脱羧酶主要分布在细胞外基质,鲜见于神经元内[15]。我们研究发现,前纹状体壳核和尾状核的背侧部的谷氨酸脱羧酶染色在舞蹈病-棘红细胞增多症明显减低。后纹状体苍白球内侧段谷氨酸脱羧酶染色显著减低,而苍白球外侧段谷氨酸脱羧酶染色减低不显著。苍白球内侧段位于直接通路(易化性通路)上,为P物质神经通路。这间接验证了在舞蹈病-棘红细胞增多症,P物质受累减少程度远甚于脑啡肽。
Calbindin-D28k具有神经保护作用,其主要机制为Calbindin-D28k可以缓冲钙超载,保护细胞免受兴奋性毒性作用的损害[16]。本研究结果表明,Calbindin-D28k染色在舞蹈病-棘红细胞增多症患者的壳核和尾状核的背侧部高度表达,其对应位置恰为脑啡肽、P物质染色和谷氨酸脱羧酶染色明显减低部位。这也印证了Calbindin-D28k对于前纹状体的神经元损伤具有代偿性的保护作用。
本研究存在以下局限性:首先,福尔马林溶液固定可能对神经生化染色有一定的影响。另外,结果的偏倚性是可能存在的。未来体视学方法和分析可以避免偏倚的产生。
总之,与间接通路(抑制性通路)在亨廷顿病显著受累不同,直接通路(易化性通路)在舞蹈病-棘红细胞增多症的病理机制中的作用也不容忽视。
[1] Walker RH, Jung HH, Danek A. Neuroacanthocytosis[J]. Handb Clin Neurol, 2011, 100:141-151.
[2] 江泓,唐北沙. 舞蹈病-棘红细胞增多症研究进展[J]. 中华神经科杂志, 2004, 37(2):178-179.
[3] Liu J, Bader B, Danek A. Neuroacanthocytosis in China: a review of published reports[J]. Tremor Other Hyperkinet Mov (N Y), 2014, 4:248.
[4] Dobson-Stone C, Velayos-Baeza A, Filippone LA, et al. Chorein detection for the diagnosis of chorea-acanthocytosis[J]. Ann Neurol, 2004, 56(2):299-302.
[5] Rampoldi L, Dobson-Stone C, Rubio JP, et al. A conserved sorting-associated protein is mutant in chorea-acanthocytosis[J]. Nat Genet, 2001, 28(2):119-120.
[6] Connolly BS, Hazrati LN, Lang AE. Neuropathological findings in chorea-acanthocytosis: new insights into mechanisms underlying parkinsonism and seizures[J]. Acta Neuropathol, 2014, 127(4):613-615.
[7] Gittis AH, Kreitzer AC. Striatal microcircuitry and movement disorders[J]. Trends Neurosci, 2012, 35(9):557-564.
[8] Deng YP, Albin RL, Penney JB, et al. Differential loss of striatal projection systems in Huntington's disease: a quantitative immunohistochemical study[J]. J Chem Neuroanat, 2004, 27(3):143-164.
[9] Choi WS, Lee E, Lim J, et al. Calbindin-D28K prevents drug-induced dopaminergic neuronal death by inhibiting caspase and calpain activity[J]. Biochem Biophys Res Commun, 2008, 371(1):127-131.
[10] Kretzschmar H. Brain banking: opportunities, challenges and meaning for the future[J]. Nat Rev Neurosci, 2009, 10(1):70-78.
[11] Mai JC, Assheuer J, Paxinos G. Atlas of the human brain[M]. San Diego: Academic Press, 1997.
[12] Ishida C, Makifuchi T, Saiki S, et al. A neuropathological study of autosomal-dominant chorea-acanthocytosis with a mutation of VPS13A[J]. Acta Neuropathol, 2009, 117(1):85-94.
[13] Reiner A, Albin RL, Anderson KD, et al. Differential loss of striatal projection neurons in Huntington disease[J]. Proc Natl Acad Sci U S A, 1988, 85(15):5733-5737.
[14] Storey E, Beal MF. Neurochemical substrates of rigidity and chorea in Huntington's disease[J]. Brain, 1993, 116(5):1201-1222.
[15] Rice MW, Roberts RC, Melendez-Ferro M, et al. Neurochemical characterization of the tree shrew dorsal striatum[J]. Front Neuroanat, 2011, 5:53.
[16] Yenari MA, Minami M, Sun GH, et al. Calbindin d28k overexpression protects striatal neurons from transient focal cerebral ischemia[J]. Stroke, 2001, 32(4):1028-1035.
