急性缺血性卒中患者阿替普酶静脉溶栓后发生早期神经功能恶化的危险因素分析
2016年12月
中华神经科杂志,第49卷第12期 第925页-第931页
崔颖,佟旭,王伊龙,郑华光,刘静,刘静华,田月明,史楠,曹亦宾
诸多临床试验证实,发病3~4.5 h内应用阿替普酶静脉溶栓能够显著降低致残率,是治疗急性缺血性卒中(acute ischemic stroke, AIS)首选方法[1,2,3,4]。尽管如此,有研究表明仍有约5%~40%的AIS患者在发病数日内,尤其24 h内出现病情进展加重,发生早期神经功能恶化(early neurological deterioration,END)[5]。到底哪些因素能够预测阿替普酶静脉溶栓后发生END,目前国内鲜有报道,亦缺乏相关大样本量临床数据。我们通过回顾性分析2006年1月至2015年5月在唐山市工人医院神经内科连续登记的发病4.5 h内给予阿替普酶静脉溶栓的AIS患者,旨在寻找发生溶栓后END的危险因素,从而为指导临床医生进行更为精准化溶栓提供依据。
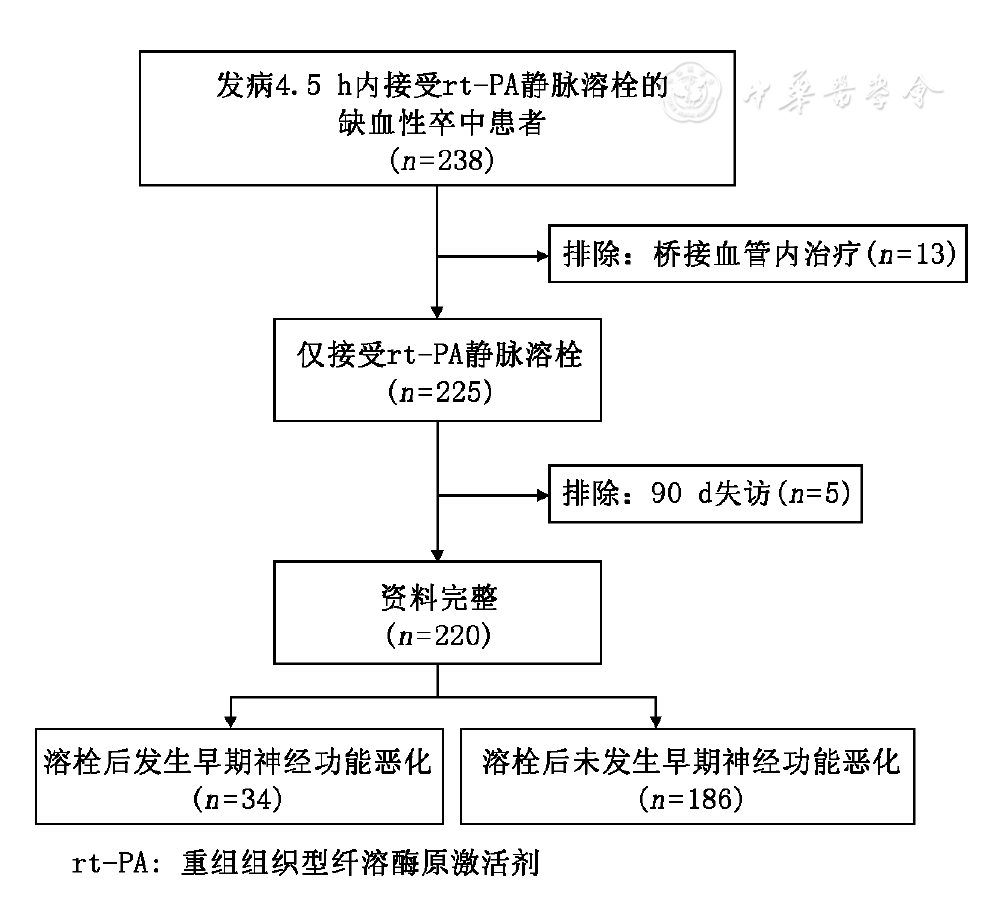
选自2006年1月至2015年5月在唐山市工人医院神经内科连续登记的发病4.5 h内接受阿替普酶(勃林格殷格翰公司,德国)静脉溶栓的AIS患者(中国临床试验中心注册号ChiCTR-OPC-15007046)。纳入标准:(1)年龄18~80岁;(2)临床诊断为缺血性卒中,并引起可评估的神经功能缺损,如运动功能、认知、语言的损害,凝视障碍,视野缺损和(或)视觉忽视;(3)卒中症状持续至少30 min,并且溶栓治疗前无明显改善;(4)在症状出现4.5 h内开始溶栓治疗。排除标准:(1)在症状出现4.5 h后开始溶栓治疗;(2)其他排除标准与美国国立神经疾病与卒中研究所(National Institute of Neurological Disorders and Stroke, NINDS)卒中溶栓研究一致[1]。所有患者在溶栓前进行NIHSS评分、实验室化验(包括血常规、血糖、电解质、肾功能、凝血功能)以及经颅脑CT或MRI检查排除颅内出血可能,并且无其他溶栓禁忌证。所有患者在溶栓后2 h、24 h、7 d、出院和病情变化时记录NIHSS评分,在溶栓后90 d通过电话或面对面随访记录改良Rankin量表(modified Rankin Scale,mRS)和Barthel指数(Barthel index,BI)的得分。所有临床量表(NIHSS、mRS、BI)的测量均需统一培训,获得资质后的医生方可进行评估和记录。我们根据溶栓后是否发生END(指溶栓后24 h内NIHSS评分较基线增加≥4分或导致死亡[6])将患者分为恶化组和非恶化组(纳入及分组流程见
本研究经唐山市工人医院伦理委员会批准(批准文号:GRYY-LL-2015-30),溶栓前经患者本人或其家属签署知情同意书。
包括年龄、性别、既往史[高血压、糖尿病、冠心病、心肌梗死、心房纤颤、心功能不全、高脂血症、既往卒中或短暂性脑缺血发作(TIA)、病前mRS评分、病前服用抗血小板药或他汀类降脂药、吸烟、饮酒]、血压、NIHSS评分、吞咽情况、意识状态、实验室检查[入院血糖、白细胞、中性粒细胞百分比、血红蛋白、血小板、国际标准化比值(INR)、纤维蛋白原、尿素氮、肌酐、尿酸、总胆固醇、低密度脂蛋白]、发病到溶栓时间、阿替普酶剂量、CT早期梗死征象(包括:脑动脉致密征:指大脑中动脉水平段、基底动脉密度增高,CT值为77~89 Hu,为血管栓塞或血栓形成所致;低密度改变:可表现为与神经功能缺损相对应区域的低密度病变、灰白质界限模糊、豆状核征、岛带征;占位效应:表现为脑沟裂变浅或消失、脑室受压、中线移位)、责任梗死部位(前循环卒中是指急性梗死灶位于颈内动脉系统;后循环卒中是指急性梗死灶位于椎基底动脉系统)、责任大血管分布(颈内动脉、大脑中动脉或基底动脉)、责任大血管狭窄程度(正常、狭窄或闭塞)及TOAST分型(大动脉粥样硬化性卒中、小动脉闭塞性卒中、心源性脑栓塞、其他病因或病因不明的卒中)。
所有统计学分析均使用SPSS 21.0软件(IBM SPSS,美国)。正态分布计量资料采用均数±标准差(
发病4.5 h内给予阿替普酶静脉溶栓治疗的AIS患者共238例,排除桥接血管内治疗13例、90 d失访5例,最终进入本研究的患者共220例。溶栓后24 h内34例(15.5%)发生END,其中靶血管未开通26例,症状性脑出血8例。
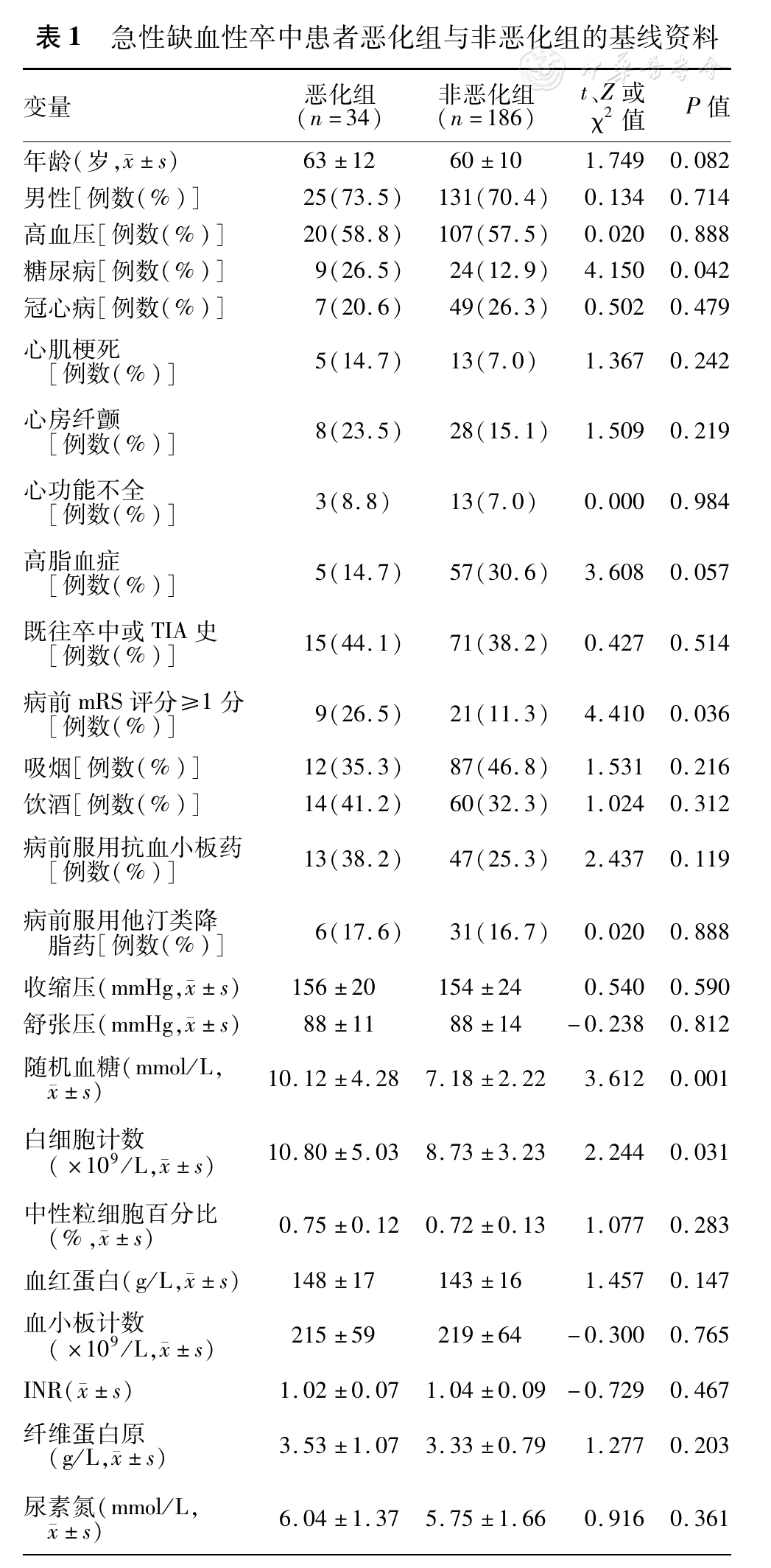
恶化组患者的既往糖尿病(分别为26.5%、12.9%)、病前mRS评分≥1分(分别为26.5%、11.3%)、吞咽障碍(分别为70.6%、39.8%)、责任大血管闭塞(分别为82.4%、49.5%)、心源性脑栓塞(分别为29.4%、17.2%)的比例以及白细胞计数(分别为10.80×109/L、8.73×109/L)、入院血糖(分别为10.12 mmol/L、7.18 mmol/L)和肌酐水平(分别为79.9 μmol/L、71.8 μmol/L)均显著高于非恶化组(均P<0.05)。另外,恶化组患者病前服用抗血小板药(分别为38.2%、25.3%)、昏迷(分别为26.5%、12.4%)、颈内动脉供血区梗死(分别为14.7%、7.5%)的比例和基线NIHSS评分(分别为17、15分)、年龄(分别为63、60岁)、血红蛋白含量(分别为148 g/L、143 g/L)均高于非恶化组,而既往高脂血症的比例(分别为14.7%、30.6%)低于非恶化组,但差异无统计学意义(0.05<P<0.20;
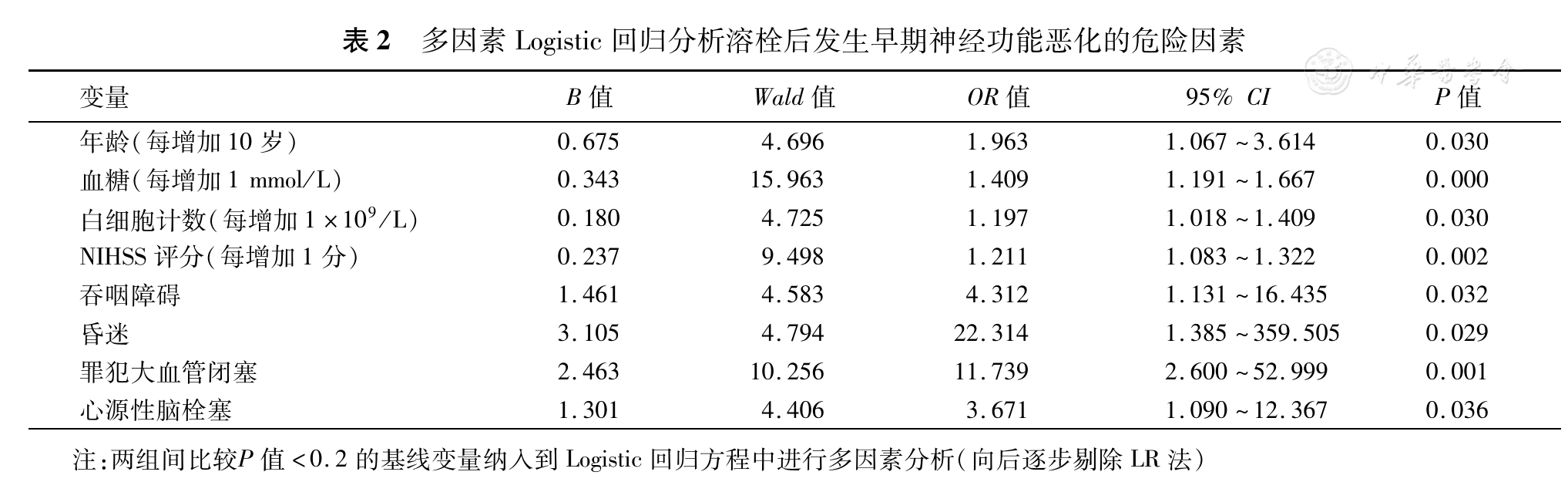
选取单因素分析中两组间比较P值<0.20的基线变量全部纳入Logistic回归方程中作为自变量,采用向后逐步剔除LR法,进一步分析溶栓后END的危险因素。结果显示:年龄(每增加10岁:OR=1.963,95% CI=1.067~3.614)、入院血糖(每增加1 mmol/L:OR=1.409,95% CI=1.191~1.667)、白细胞计数(每增加1×109/L:OR=1.197,95% CI=1.018~1.409)、基线NIHSS评分(每增加1分:OR=1.267,95% CI=1.091~1.475)、吞咽障碍(OR=4.312,95% CI=1.131~16.435)、昏迷(OR=22.314,95% CI=1.385~359.505)、责任大血管闭塞(OR=11.739,95% CI=2.600~52.999)和心源性脑栓塞(OR=3.671,95% CI=1.090~12.367)与溶栓后END显著相关(均P<0.05;
近年,脑血管疾病已跃居城市第二位、农村第一位死亡原因[7],其中AIS致残、致死率极高,严重威胁患者生命健康。阿替普酶是目前世界上唯一被批准并推荐用于治疗此病的一线药物,国外几项大型临床试验及安全监测性研究均证实其在症状出现3~4.5 h内用于静脉溶栓的安全性和有效性[2,3,4,8]。尽管如此,仍有相当一部分患者并未从中获益,发生END,病情再次加重。END发生率对应不同定义亦不相同。我们选取近年来应用最广泛的定义,即溶栓后24 h内NIHSS评分较基线增加≥4分或导致死亡[6]。国外针对11项阿替普酶静脉溶栓后END发生率的汇总分析显示,24 h内END发生率约为8.1%~28.1%[5,9],本研究END发生率15.5%,在此范围内。
此研究各项数据表明:高龄、较高的入院血糖水平、白细胞计数及基线NIHSS评分、吞咽障碍、昏迷、责任大血管闭塞及心源性脑栓塞为AIS患者阿替普酶静脉溶栓治疗后24 h内发生END的危险因素。
本研究得出高龄为AIS患者阿替普酶静脉溶栓后发生END的危险因素之一。据统计,卒中事件人群约1/3为年龄≥80岁的高龄患者,卒中为此年龄段第一位致死原因[10]。目前国外文献对于高龄是否为静脉溶栓后发生END的危险因素众说纷纭。尽管德、法两国有研究得出年龄≥80岁并非静脉溶栓绝对禁忌,但由于样本量限制及缺乏长期随访数据等原因各有局限[11,12]。高龄患者身体各方面素质显著下降,全身性疾病发生率增高,血管调节功能差,一旦发生脑血管事件,严重程度较非高龄患者更重。同时,导致高龄患者发生AIS多为心房颤动、区域性梗死以及抗血小板治疗等,均易早期引发溶栓后症状性颅内出血(symptomatic intracranial hemorrhage, sICH)、恶性颅内水肿等并发症,增加END发生风险,抵消静脉溶栓获益。此外,更严格的溶栓时间窗限制,缺乏活动力和执行力等亦为影响因素。
本研究结果显示较高的入院血糖水平为溶栓后END发生的危险因素,此前也有文献证实,较高入院血糖水平与静脉溶栓再通失败及不良预后显著相关[13,14]。虽然近期有研究发现较高入院血糖水平对溶栓后腔隙性脑梗死患者并无预后不良提示[15],但因溶栓治疗的腔隙性脑梗死患者样本量较少,且缺乏准确的临床分型方法,研究结果有待进一步证实。较高入院血糖水平可能加重缺血半暗带无氧糖酵解过程,脑组织发生细胞内酸中毒导致线粒体功能紊乱、自由基生成增多,处于危险边缘的低灌注脑组织容易形成新的梗死[16]。高血糖还可增加血脑屏障破坏,削弱其保护作用,增加sICH风险[17],且可产生凝血素效应,促使栓子扩大,加重栓塞部位脑组织缺血程度[18]。此外,高血糖患者血管多有不同程度受损,对于血压波动及各种治疗调节能力和耐受性均差,不利于梗死部位新的侧支循环建立。
我们统计的数据显示,END组白细胞计数水平明显高于非END组,差异有统计学意义(P<0.05),表明AIS患者较高的白细胞计数水平在静脉溶栓后END发生、发展过程中扮演重要角色。AIS早期,白细胞的聚集与黏附将妨碍脑组织局部血液循环通畅性,一定程度阻碍侧支循环的有效建立。同时,白细胞释放多种炎性物质导致血管收缩、通透性增加,例如:白细胞介素-1β可作用于内皮细胞上调内皮素-1的产生,即使溶栓后血管再通,后者亦将阻碍梗死灶脑血流量恢复,梗死面积扩大,引发END[19]。有文献报道,AIS患者高水平白细胞计数与sICH独立相关[20],继而增加溶栓后END发生风险。在动物模型中,梗死血管再灌注期间、白细胞聚集呈进行性增加,而溶栓治疗会触发且升级炎性反应的瀑布效应[21],这种效应被机体固有的免疫应答逐渐放大,可能导致二次组织损伤,引发END。
NIHSS评分用来评价急性脑卒中患者神经功能缺损程度。较高水平基线NIHSS评分在某种程度上提示AIS患者神经损伤严重,而后者强烈预示出血转化[22]及恶性脑水肿[23]后续发生,引发END。本研究中经静脉溶栓治疗的AIS患者中,发生END的基线NIHSS中位评分为17,而未发生END的中位评分为15,也说明神经功能损伤程度较严重的患者发生END可能性更大。有文献报道,基线NIHSS评分为11分和12分可分别作为识别静脉溶栓治疗后基线血管闭塞和功能独立性情况的参考标识,并且这种识别价值具有时间依赖性[24]。因此,NIHSS评分不仅为测量及评价急性卒中病情严重程度的工具,更是对患者预后情况进行识别及前瞻性预测的工具。据笔者所知,针对静脉溶栓后患者,NIHSS评分功能及意义的研究数量仍较少,在以后的科研工作中还需进一步探索。
吞咽障碍是脑梗死后常见并发症之一。本研究中,34例静脉溶栓后发生END患者有24例发生不同程度吞咽障碍,经多因素Logistic回归分析发现,吞咽障碍为AIS患者阿替普酶静脉溶栓治疗后24 h内发生END的危险因素之一。目前国内外文献类似结论尚属少数,但推测其机制大致为以下几个方面:(1)脑血管事件后,波及患者饮食过程,吞咽障碍患者营养成分摄入更少易致营养不良,机体免疫力下降,对各种疾病易患性增加,导致病情加重。(2)由于吞咽动作无力、不协调,食物及痰液极易于呼吸时进入气管,导致误吸;此外,吞咽障碍患者多早期行鼻饲治疗,影响食管括约肌正常功能完整性,易发生食物反流,引起误吸。此两种情况均可导致吸入性肺炎发生,加重病情。有文献报道,伴吞咽障碍的急性卒中患者发生肺炎的概率是无吞咽障碍患者3倍,脑损伤严重且确诊误吸的卒中患者,发生肺炎的几率是未发生误吸患者的11倍[25]。(3)吞咽障碍患者对吞咽食物易产生恐惧心理,吞咽过程更易发生误吸,继而拒绝进食及治疗,甚至引发焦虑、抑郁,不利患者病情恢复。综上,吞咽障碍易导致患者病情加重,从各个方面削弱患者自身状况,易致END发生。
昏迷指意识完全丧失,是严重的意识障碍,多数研究将其视为溶栓相对禁忌证。我们回顾性分析了此类人群接受阿替普酶静脉溶栓与治疗后24 h内发生END的关系,发现昏迷为溶栓后END危险因素之一。近年,不断有学者对静脉溶栓禁忌证的设立提出新的看法,以期能够扩大静脉溶栓适应证人群,让更多AIS患者获益。近期,有文献报道,症状出现4.5 h内对意识下降患者人群行静脉溶栓治疗利大于弊[26],但此研究为非随机试验,且尚缺乏明确的意识障碍程度划分,因此研究结果需理性看待。尽管临床上昏迷患者常提示椎-基底动脉系统存在梗死灶,尽快行静脉溶栓治疗或可改善患者预后,但不容否认的是昏迷患者各方面状况常较差,身体机能处于停滞甚至失代偿状态,静脉溶栓治疗后再灌注损伤往往较非昏迷患者严重,极易引发END。对于这一争议,尚需设计更加合理、样本量更大、安全性更高的试验明确结论。
责任大血管主要指起自颈内动脉的Willis环及脑表面直径>0.1 mm的血管,血管闭塞过程通常源于颅内大动脉的动脉粥样硬化斑块形成。一项研究显示,因大血管闭塞发病的人群约占急性脑卒中患者的28%~46%,并且此类患者较其他患者多出4.5倍的病死率及3倍的预后不良风险[27]。然而,阿替普酶对于颈内动脉及大脑中动脉等大血管闭塞的静脉溶栓却效果有限[28]。有研究表明,责任大血管闭塞承担着更大的血栓负担,血栓体积大,溶解过程难度增加;并且,血栓多为原位动脉粥样硬化性血栓形成,而此类血栓相较于富含纤维成分的栓子更难溶解;此外,责任大血管闭塞导致短时血流减少,远端血管灌注不足,大面积脑组织缺血缺氧,不利缺血半暗带的挽救;最后,有研究表明,进展性脑卒中梗死部位以大血管管辖的分水岭区及侧脑室体旁多见,可能与这些区域在梗死发生后不易建立丰富的侧支循环有关[29]。以上原因均不利于溶栓后血管顺利再通,易导致END发生。
TOAST亚型分类标准中,心源性脑栓塞为其重要分型。此类型由多种可产生心源性栓子的心脏疾病引起脑栓塞。本研究结果表明,心源性脑栓塞为AIS患者静脉溶栓后发生END的危险因素之一。心源性脑栓塞亚型虽所占比例不多,但患者入院时多病情危急,神经功能缺损程度严重,基线NIHSS评分较高。国内一项比较心源性脑栓塞和大动脉粥样硬化性栓塞(large-artery atherosclerosis, LAA)两种亚型静脉溶栓治疗后自发性出血情况、病死率及3个月日常生活能力的大型队列研究表明,心源性脑栓塞亚型患者静脉溶栓后sICH风险较LAA亚型更高,且3个月临床转归及预后情况均较LAA亚型更差[30]。虽然理论上心源性栓子富含纤维蛋白及红细胞,相较富含血小板且更加致密的粥样斑块更易被溶解,但相关研究结果却颇具争议。可能与来自心脏疾病的栓子不稳定、易脱落相关,且有研究观察到来自左心房的栓子大小是动脉粥样硬化性栓子的3倍,更易突然堵塞大血管,引发AIS,加重病情[31]。
本研究有一定局限性。首先,本研究为北方单一城市单中心研究,由于地方性人群特点,难免对结果造成偏倚,所得结果尚需其他队列进一步证实;其次,这是一项回顾性研究,尽管校正了一些混杂因素,也难免出现入组患者的选择偏倚及一些临床情况的回忆偏倚,因此得出结论还需预设暴露的前瞻性队列研究来验证;同时,某些影响因素尚缺乏进一步合理的程度划分,得出结论可能不够具体。
阿替普酶静脉溶栓治疗是把双刃剑,我们的研究结果提示:高龄、较高的随机血糖水平、白细胞计数及基线NIHSS评分、吞咽障碍、昏迷、责任大血管闭塞及心源性脑栓塞与静脉溶栓后发生END显著相关。建议临床针对怀疑合并以上危险因素的患者,在采取静脉溶栓治疗前,尽快完善相关检查,结合检查结果对高危患者进行综合分析、筛查、分类,可接受治疗的患者溶栓过程中应密切监视,不宜溶栓治疗的患者尽早采取其他有效治疗,以达到AIS患者安全、有效治疗的目的。
[1] The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke[J]. N Engl J Med, 1995, 333(24): 1581-1587.
[2] Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J]. N Engl J Med, 2008, 359(13): 1317-1329.
[3] Wahlgren N, Ahmed N, Davalos A, et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST): an observational study[J]. Lancet, 2007, 369(9558): 275-282.
[4] Wahlgren N, Ahmed N, Davalos A, et al. Thrombolysis with alteplase 3-4.5 h after acute ischaemic stroke (SITS-ISTR): an observational study[J]. Lancet, 2008, 372(9646): 1303-1309.
[5] Seners P, Turc G, Oppenheim C, et al. Incidence, causes and predictors of neurological deterioration occurring within 24 h following acute ischaemic stroke: a systematic review with pathophysiological implications[J]. J Neurol Neurosurg Psychiatry, 2015, 86(1): 87-94.
[6] Tisserand M, Seners P, Turc G, et al. Mechanisms of unexplained neurological deterioration after intravenous thrombolysis[J]. Stroke, 2014, 45(12): 3527-3534.
[7] 卫生部新闻办公室.第三次全国死因调查主要情况[J].中国肿瘤,2008, 17(5): 344-345.
[8] Hill MD, Buchan AM. Thrombolysis for acute ischemic stroke: results of the Canadian Alteplase for Stroke Effectiveness Study[J]. CMAJ, 2005, 172(10): 1307-1312.
[9] Hacke W, Donnan G, Fieschi C, et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and NINDS rt-PA stroke trials[J]. Lancet, 2004, 363(9411): 768-774.
[10] Russo T, Felzani G, Marini C. Stroke in the very old: a systematic review of studies on incidence, outcome, and resource use[J]. J Aging Res, 2011, 2011: 108785.
[11] Reuter B, Gumbinger C, Sauer T, et al. Intravenous thrombolysis for acute ischaemic stroke in the elderly: data from the Baden-Wuerttemberg stroke registry[J]. Eur J Neurol, 2016, 23(1): 13-20.
[12] Mione G, Ducrocq X, Thilly N, et al. Outcome of intravenous recombinant tissue plasminogen activator for acute ischemic stroke in patients aged over 80 years[J]. Geriatr Gerontol Int, 2016, 16(7): 843-849.
[13] Saqqur M, Shuaib A, Alexandrov AV, et al. The correlation between admission blood glucose and intravenous rt-PA-induced arterial recanalization in acute ischemic stroke: a multi-centre TCD study[J]. Int J Stroke, 2015, 10(7): 1087-1092.
[14] Mori M, Naganuma M, Okada Y, et al. Early neurological deterioration within 24 hours after intravenous rt-PA therapy for stroke patients: the Stroke Acute Management with Urgent Risk Factor Assessment and Improvement rt-PA Registry[J]. Cerebrovasc Dis, 2012, 34(2): 140-146.
[15] Miedema I, Luijckx GJ, Brouns R, et al. Admission hyperglycemia and outcome after intravenous thrombolysis: is there a difference among the stroke-subtypes?[J]. BMC Neurol, 2016, 16: 104.
[16] Alvarez-Sabin J, Molina CA, Montaner J, et al. Effects of admission hyperglycemia on stroke outcome in reperfused tissue plasminogen activator-treated patients[J]. Stroke, 2003, 34(5): 1235-1241.
[17] Ennis SR, Keep RF. Effect of sustained-mild and transient-severe hyperglycemia on ischemia-induced blood-brain barrier opening[J]. J Cereb Blood Flow Metab, 2007, 27(9): 1573-1582.
[18] Lemkes BA, Hermanides J, Devries JH, et al. Hyperglycemia: a prothrombotic factor?[J]. J Thromb Haemost, 2010, 8(8): 1663-1669.
[19] Murray KN, Girard S, Holmes WM, et al. Systemic inflammation impairs tissue reperfusion through endothelin-dependent mechanisms in cerebral ischemia[J]. Stroke, 2014, 45(11): 3412-3419.
[20] Tiainen M, Meretoja A, Strbian D, et al. Body temperature, blood infection parameters, and outcome of thrombolysis-treated ischemic stroke patients[J]. Int J Stroke, 2013, 8(8): 632-638.
[21] Villemure C, Bushnell MC. Mood influences supraspinal pain processing separately from attention[J]. J Neurosci, 2009, 29(3): 705-715.
[22] Whiteley WN, Slot KB, Fernandes P, et al. Risk factors for intracranial hemorrhage in acute ischemic stroke patients treated with recombinant tissue plasminogen activator: a systematic review and meta-analysis of 55 studies[J]. Stroke, 2012, 43(11): 2904-2909.
[23] Strbian D, Meretoja A, Putaala J, et al. Cerebral edema in acute ischemic stroke patients treated with intravenous thrombolysis[J]. Int J Stroke, 2013, 8(7): 529-534.
[24] Cooray C, Fekete K, Mikulik R, et al. Threshold for NIH stroke scale in predicting vessel occlusion and functional outcome after stroke thrombolysis[J]. Int J Stroke, 2015, 10(6): 822-829.
[25] Martino R, Foley N, Bhogal S, et al. Dysphagia after stroke: incidence, diagnosis, and pulmonary complications[J]. Stroke, 2005, 36(12): 2756-2763.
[26] Chen C, Ye M, Chen BL, et al. Thrombolysis on ischemic stroke patients with decreased level of consciousness within 4.5 h[J]. CNS Neurosci Ther, 2013, 19(1): 48-52.
[27] Smith WS, Lev MH, English JD, et al. Significance of large vessel intracranial occlusion causing acute ischemic stroke and TIA[J]. Stroke, 2009, 40(12): 3834-3840.
[28] Saqqur M, Uchino K, Demchuk AM, et al. Site of arterial occlusion identified by transcranial Doppler predicts the response to intravenous thrombolysis for stroke[J]. Stroke, 2007, 38(3): 948-954.
[29] 贾丽君,迟鲁梅,范佳,等. 进展性卒中的临床分析[J]. 中风与神经疾病杂志,2008, 25(2): 191-193.
[30] Wang XG, Zhang LQ, Liao XL, et al. Unfavorable Outcome of Thrombolysis in Chinese Patients with Cardioembolic Stroke: a Prospective Cohort Study[J]. CNS Neurosci Ther, 2015, 21(8): 657-661.
[31] Sato Y, Ishibashi-Ueda H, Iwakiri T, et al. Thrombus components in cardioembolic and atherothrombotic strokes[J]. Thromb Res, 2012, 130(2): 278-280.
