中国蛛网膜下腔出血诊治指南2019
2019年12月
中华神经科杂志,第52卷第12期 第1006页-第1021页
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是指脑底部或脑表面血管破裂后,血液流入蛛网膜下腔引起相应临床症状的一种脑卒中,占所有脑卒中的5%~10%。颅内动脉瘤是SAH最常见的病因(85%),其他病因包括非动脉瘤性中脑周围出血(perimesencephalic subarachnoid hemorrhage,PMSAH)、脑动静脉畸形(brain arteriovenous malformation,bAVM)、脑底异常血管网病、硬脑膜动静脉瘘、夹层动脉瘤、血管炎、颅内静脉系统血栓形成、结缔组织病、颅内肿瘤、血液病、凝血障碍性疾病及抗凝治疗并发症等,部分患者原因不明。SAH多合并复杂严重的并发症,即便存活,患者仍易残留神经功能缺损,严重影响日常生活质量。因此,国内外研究者一直在积极探寻针对SAH有效的诊断及治疗方案。大量的临床试验显示,早期、积极及合理的救治可以改善SAH患者的临床转归。中华医学会神经病学分会脑血管病学组先后于2007年、2015年发表了SAH相关诊治指南。2015年以后,一些高质量多中心随机对照试验的结果陆续发表,特别在颅内动脉瘤的破裂风险评估、治疗选择等方面提出了新的循证依据。基于上述背景,中华医学会神经病学分会脑血管病学组及神经介入协作组组织了专家对2015年版指南进行重新修订,形成新版指南以指导临床医师进行最优临床抉择。本指南主要针对非外伤性SAH(包括中脑周围SAH)而制定,基于循证医学原则,我们在2015版指南的相关证据基础上,通过计算机检索更新和涵盖了截至2019年3月30日下列数据库发表的文献:Pubmed、Embase、Cochrane、Google Scholar、中国生物医学文献数据库(Chinese Biological Medical Database,CBM)、维普中文科技期刊数据库(VIP Database for Chinese Technical Periodicals,VIP)、中国知网(China National Knowledge Infrastructure,CNKI),全面收集SAH相关的临床研究并进行筛选作为证据。本文的推荐类别和证据级别参考《中国急性缺血性脑卒中诊治指南2018》[1]。
据统计,美国非创伤性SAH的发病率为(7.2~9.0)/10万人年,该数据在过去30年中保持稳定[2]。而在非创伤性SAH中,病因主要是动脉瘤,约占全部病例的85%。20世纪末期,世界卫生组织(World Health Organization,WHO)一项调查11个国家SAH年发病率的研究显示,中国的发病率仅为2.0/10万人年,而芬兰高达22.5/10万人年[3]。在另一项2007年的系统性回顾分析研究中,日本和芬兰SAH的发病率分别为22.7/10万人年和19.7/10万人年,而美洲中南部为4.2/10万人年,其他国家和地区发病率约为9.1/10万人年[4]。大多数研究表明,女性动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)的发病率高于男性,约为男性的1.24倍,其差异可能与激素水平相关。相关研究表明,对停经后女性而言,性激素替代治疗者SAH的发病率高于未使用性激素替代治疗者[5]。SAH的发病率还存在人种差异。黑人和西班牙裔SAH的发病率高于美国白人。SAH的发病率还与年龄有关,aSAH好发于40~60岁(平均≥50岁),儿童亦可发生,发病率随年龄增大而升高[6,7]。
在美国,有5%的脑血管病患者为SAH,其中aSAH患者的患病率为80/10万。每年大约有1%~2%的动脉瘤患者经过治疗后仍有新的动脉瘤形成,而多发性颅内动脉瘤患者更容易形成新的动脉瘤。目前动脉瘤形成的病因仍不清楚[7]。有动脉瘤家族史的人群患病率高达9.5%,且超过90%的动脉瘤直径<10 mm,90%位于前循环[8]。
SAH患者病死率较高。MONICA研究[3]提示,SAH发病后24 h、48 h、7 d和28 d的病死率分别为37%、60%、75%和41.7%。60岁以上者患SAH后1、7和30 d的死亡风险较60岁以下者更高。患者发病后的神经功能状态,尤其是患者的意识水平是决定SAH预后的最重要因素。此外,影响预后的因素还包括出血量[8,9]、脑水肿、迟发型神经功能恶化等。SAH的住院病死率为30%(1979—1983年)和20%(2004—2008年)[2]。病死率的下降可能得益于神经血管成像、神经介入和神经重症监护的发展[10]。影响病死率的因素可分为3类:患者因素、动脉瘤因素、医疗机构因素。患者因素包括早期出血的严重程度、年龄、性别、就诊时间及合并症(如高血压、心房颤动、充血性心力衰竭、冠状动脉病变、肾脏疾病等)。动脉瘤因素包括大小、形态及位置。医疗机构因素包括是否开展介入治疗、SAH患者接诊量及首选的检查。每年诊治SAH<10例的医院30 d病死率远远高于诊治35例以上的医院(39%与27%;OR=1.4)[11]。脑动静脉畸形出血(包括SAH)后的年致残率和致死率分别约为1.7%和1.0%[12]。
危险因素可分为SAH的危险因素和动脉瘤危险因素。
SAH的独立的危险因素主要有吸烟、过量饮酒和高血压。多项队列研究和病例对照研究结果表明吸烟是SAH的最重要独立危险因素。在欧洲和北美洲,SAH患者的吸烟率(45%~75%)明显高于普通人群(20%~35%)。40%的SAH病例可归咎于吸烟[13,14,15]。作为SAH的另外一个独立危险因素,多项队列研究和病例对照研究均表明大量饮酒会增加SAH的风险,且独立于吸烟、年龄和高血压病史[13,14,16,17]。与吸烟和饮酒相比,高血压作为SAH的一个危险因素的作用似乎没有那么重要。SAH患者的高血压患病率(20%~45%)略高于普通人群。相关病例对照研究证实,校正年龄、性别、吸烟和饮酒后,高血压并不会显著增加SAH的风险。然而,对所有队列研究和病例对照研究进行的系统评价表明高血压仍然是一个重要的危险因素[16]。
动脉瘤的危险因素可分为3类:动脉瘤发生的危险因素、动脉瘤增大及形态改变的危险因素、动脉瘤破裂的危险因素。这些危险因素分为可干预和不可干预两种。可干预的因素包括:吸烟、酗酒、高血压、低脂血症、治疗时不全栓塞以及女性的激素替代治疗;不可干预因素包括:性别、年龄、动脉瘤或SAH家族史、多发动脉瘤、脑动静脉畸形、常染色体显性多囊肾病。一项纳入8 680例无症状人群进行颅脑磁共振血管造影(MRA)检查的研究发现,具有动脉瘤家族史的人,动脉瘤的发病率可高达10.5%[18]。吸烟是影响动脉瘤形成和增大的独立危险因素,戒烟可降低aSAH发生的风险,并且戒烟时间与aSAH风险呈负相关。无论男性还是女性,大量饮酒都会增加aSAH发生的风险。众所周知,高血压是出血性卒中的危险因素之一,基于队列研究和病例对照研究的系统评价指出高血压亦是aSAH重要的危险因素;但也有研究报道,经校正年龄、性别、吸烟及饮酒等危险因素,高血压病史并未显著增加aSAH发生的风险。与老年人相比,年轻人严格控制主要危险因素的预后更佳[7]。另有研究表明,滥用多种药物如可卡因[19]和苯丙醇胺[20]可促进动脉瘤的发生和破裂。
推荐意见:(1)SAH的病死率很高,应该尽快行脑血管检查以明确病因,及时治疗(Ⅰ级推荐,B级证据)。(2)动脉瘤、高血压、吸烟、酗酒等为SAH的独立危险因素,滥用多种药物,如可卡因和苯丙醇胺与SAH的发病相关(Ⅰ级推荐,B级证据)。(3)如果一级亲属中有2例以上aSAH者,建议做CT血管造影(CTA)或MRA进行动脉瘤筛查(Ⅲ级推荐,C级证据)。(4)动脉瘤增大可能会增高破裂风险,应对未破裂动脉瘤进行定期影像学随访(Ⅰ级推荐,B级证据)。(5)在讨论动脉瘤风险时,除年龄、动脉瘤部位和大小外,尤其要考虑动脉瘤的形态学和血流动力学的因素(Ⅱ级推荐,B级证据)。
大多数SAH患者因剧烈头痛急诊就医。头痛、脑膜刺激征阳性及头颅CT提示蛛网膜下腔高密度影是经典的诊断标准。SAH患者的急诊诊断和处理与其预后密切相关,且需要神经科、放射科、神经介入医生等共同合作,争取及早诊断,以免漏诊、误诊和贻误治疗。
SAH患者的最突出的临床症状是头痛[21],无论在重体力活动时或情绪激动状态下还是正常活动期间均可发病,发病时还可伴有恶心、呕吐、意识障碍、局灶性神经功能缺损、癫痫发作和脑膜刺激征。研究表明,12%的症状不典型SAH患者(神经功能缺损不明显,Hunt-Hess Ⅰ~Ⅱ级)首次就诊时易被临床医生误诊,其病后12个月病死率增加近4倍[22]。其中最常见的误诊原因是未能及时接受头颅CT平扫、腰椎穿刺检查[23,24,25]。因此,若临床上怀疑SAH时,应及时完善头颅CT平扫检查,必要时结合腰椎穿刺进行诊断分析,避免误诊或漏诊。
CT是SAH诊断的首选检查。一项基于5个研究(n=8 907)的系统评价[26]指出,对于出现雷击样头痛和神经系统检查正常的患者,头痛6 h内颅脑CT检查正常对排除aSAH极为敏感。在发病后6 h内,CT诊断SAH的敏感度为100%,发病6 h后敏感度为85.7%[27]。头颅CT平扫可显示bAVM潜在的特征性血管改变,如等密度或局部稍高密度、迂曲的血管结构,病灶内可见散在分布的钙化灶[28]。
若患者病情许可,SAH患者均需行病因学检查。随着影像技术的发展,高分辨CTA对颅内动脉瘤的诊断价值逐渐得到认可。CTA诊断动脉瘤的整体敏感度约为98%,特异度为100%[29]。CTA具有快速成像、易普及等优势,还能显示动脉瘤形态、载瘤动脉与骨性结构的关系,以指导手术方式的选择及夹闭手术方案的制定。
然而,动脉瘤的大小、部位和影像设备质量影响着CTA检查的敏感度及特异度。当动脉瘤直径≤3 mm时,CTA的诊断结果并不可靠,敏感度仅为40%~90%[30]。因此,对于CTA结果阴性的aSAH患者的进一步处理尚存在争议。对于CTA结果显示阴性时,特别是出血伴有意识丧失等临床状况欠佳时,需进行二维或三维脑血管造影检查以明确诊断[9,31]。Agid等[32]回顾性地纳入193例CTA阴性的自发性SAH患者进行研究,结果显示当头颅CT表现为典型的PMSAH征象或无出血时,CTA阴性能可靠地排除动脉瘤。因此,对于CTA显示阴性的PMSAH患者,应个体化评估其病情再决定是否进一步行数字减影血管造影(DSA)检查。
此外,CTA对bAVM而言还是一种安全可靠的诊断工具,具有较好的临床诊断及临床决策指导应用价值。三维CTA除了可以完整清晰地显示AVM全貌、分辨引流静脉系统和供血动脉系统以及对引流静脉其导入静脉窦全程进行显影外,还能帮助临床医师了解毗邻的三维影像,为临床制定最佳治疗方案提供更全面的影像学信息[33,34]。
MRI也是确诊SAH的主要辅助诊断技术。FLAIR序列、质子密度成像、DWI、梯度回波序列等多种MRI序列均有助于SAH的诊断。在SAH急性期,MRI的敏感度与CT相近,但在疾病亚急性期及慢性期,其诊断敏感度优于CT[35]。一个纳入18项研究共计3 463例患者的系统评价显示:三维时间飞跃法磁共振血管造影(three dimensional time of flight magnetic resonance angiography,3D-TOF-MRA)诊断颅内动脉瘤的敏感度为89%、特异度为94%;诊断敏感度与动脉瘤大小有关,与直径≤3 mm相比,3D-TOF-MRA对直径>3 mm动脉瘤敏感度更高。与aSAH患者相比,MRA对未破裂的动脉瘤检出率更高[36]。MRA一般情况下无需碘造影、无离子辐射,适用于孕妇,可用于SAH的病因筛查。但MRA在判断动脉瘤颈与所属血管关系方面存在局限性。
MRI和MRA在诊断bAVM方面也有一定参考价值,在MRI的T1加权像和T2加权像上,bAVM患者的畸形血管团、供血动脉和引流静脉因血管流空效应而表现为混杂信号,MRI还可清晰显示畸形团和毗邻结构的关系。MRA显示血管畸形优于MRI,能清楚显示异常畸形血管团、供血动脉和引流静脉以及提供血管的三维结构[37]。然而不管是时间飞跃法还是对比增强法,MRA在显示更小的血管(直径<1 mm)、动脉瘤[38,39]、更小的bAVM病灶(<10 mm)[40]以及静脉流出道解剖特点方面均存在局限性。
DSA是动脉瘤和bAVM诊断的金标准。有20%~25%的aSAH患者首次DSA阴性,1周后复查DSA有1%~2%的上述患者可发现动脉瘤[7]。高质量的旋转造影和三维重建DSA(3D-DSA)对动脉瘤检出率高,同时有利于构建动脉瘤形态、显示瘤颈与邻近血管关系及指导治疗选择[7]。对于血管内治疗术前评估、复杂动脉瘤以及CTA不能明确病因的SAH患者(典型的中脑周围性aSAH除外)均需要进行全脑DSA检查。若颅脑CT平扫显示弥漫性动脉瘤样出血,则需进一步完善DSA,若首次DSA结果阴性,则需延期复查,有14%的患者可检出小动脉瘤;有研究者认为,在发病后2~12周复查血管影像学检查对弥漫性SAH患者是有价值的[32,41,42,43]。
DSA仍是诊断bAVM最可靠、最重要的方法。一项针对颅内出血(含69例SAH患者)的前瞻性多中心队列研究显示,无论是单独应用CTA检查还是CTA和MRI/MRA联合检查均容易漏诊bAVM[44]。经CT或MRI识别或怀疑为bAVM的患者,通常需要进一步行DSA检查以指导治疗。DSA在显示微小的畸形血管团方面较CTA或MRA更有优势[45]。DSA还能明确bAVM患者的血管结构特征和血流动力学信息。由于邻近血肿的占位效应,DSA在某些bAVM患者出血急性期可呈阴性,待血肿吸收后DSA可清楚显示畸形团[37],因此,此类患者血肿吸收后有必要复查血管造影。但DSA为有创检查,存在一定的风险,对于首次DSA阴性的SAH患者是否进行二次检查应视具体情况而定。
对于疑诊SAH但CT结果阴性的患者,需进一步行腰椎穿刺检查。无色透明的正常脑脊液可以帮助排除最近2~3周内发病的SAH;均匀血性的脑脊液可支持SAH的诊断,但需注意排除穿刺过程中损伤出血的可能;脑脊液黄变是红细胞裂解生成的氧合血红蛋白及胆红素所致,脑脊液黄变提示陈旧性SAH。
应完善血常规、血糖、凝血功能、血气分析、心肌酶谱、肌钙蛋白等检查。有研究提示肌钙蛋白升高、脑利钠肽升高均与SAH后迟发脑缺血(delayed cerebral ischemia,DCI)预后不良及死亡相关[46],应重视检测上述指标。
SAH后常常合并心肌损伤,异常心电(如P波高尖、QT间期延长和T波增高等)常提示SAH患者合并心肌损伤。与单纯SAH患者相比,SAH伴神经源性肺水肿患者发生心电图异常改变的可能性更大,心电图异常改变在某种程度上可预测SAH患者24 h内神经源性肺水肿的进展[47]。
SAH的临床特点包括突发头痛,伴恶心、呕吐、意识障碍、癫痫、脑膜刺激征阳性及头颅CT提示蛛网膜下腔高密度影。若症状不典型、头颅CT阴性,仍疑诊SAH,则应尽早行腰椎穿刺检查,均匀血性脑脊液亦可确诊SAH。SAH需与偏头痛发作、脑膜炎等鉴别。若CT扫描发现纵裂或横窦区域有高密度影,还应注意与颅内静脉窦血栓形成进行鉴别。自发性SAH患者诊疗流程见
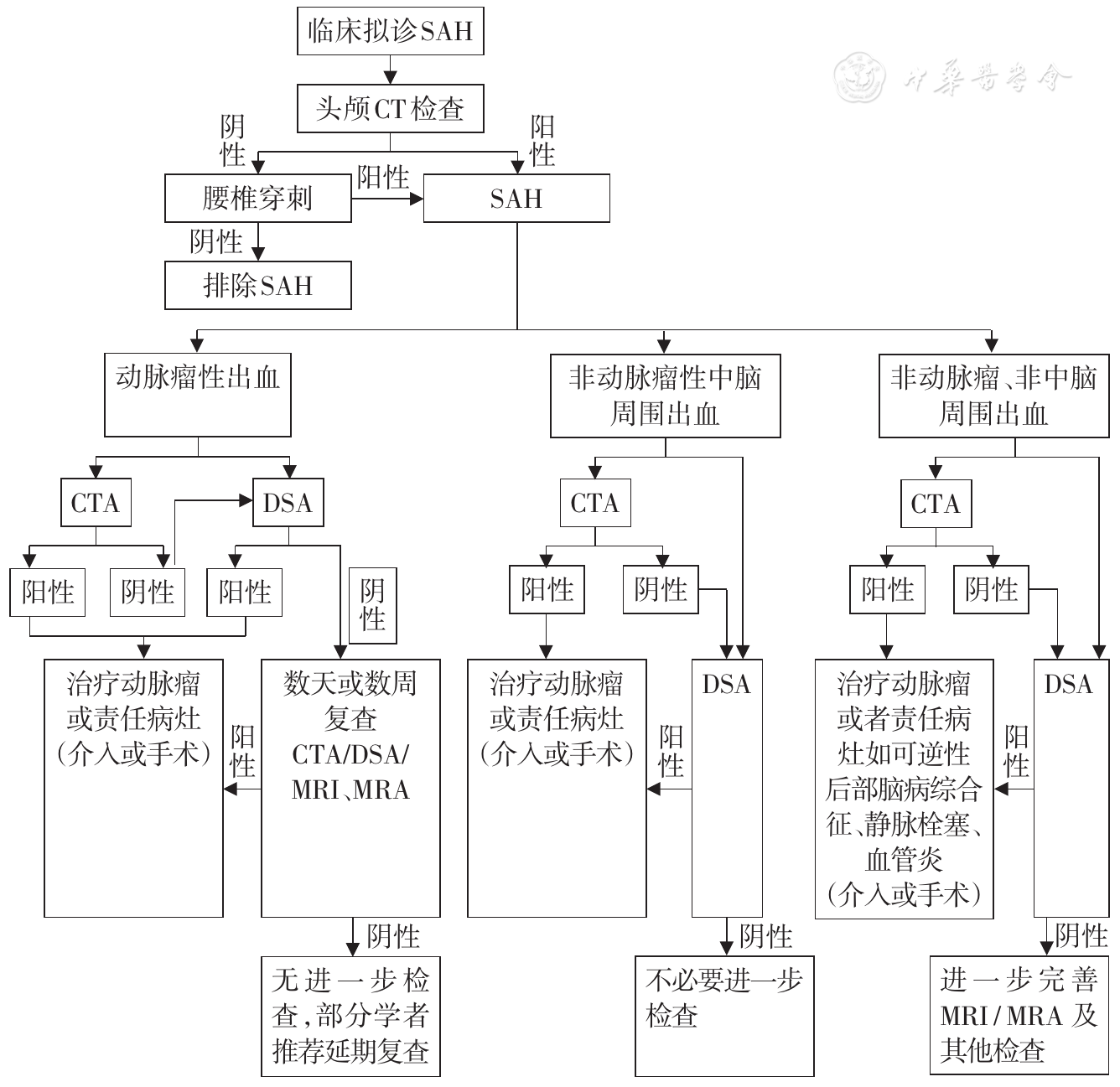
CTA:CT血管造影;DSA:数字减影血管造影;MRA:磁共振血管造影
SAH患者就诊后,应全面采集病史,了解有无SAH危险因素(如吸烟、酗酒等)、药物滥用史(年轻患者应予毒物筛查)、可能影响预后的相关因素如年龄、既往高血压史、就诊时间、入院时血压等,并完善体格检查。
SAH患者目前常用的临床分级评分量表包括Hunt-Hess量表(


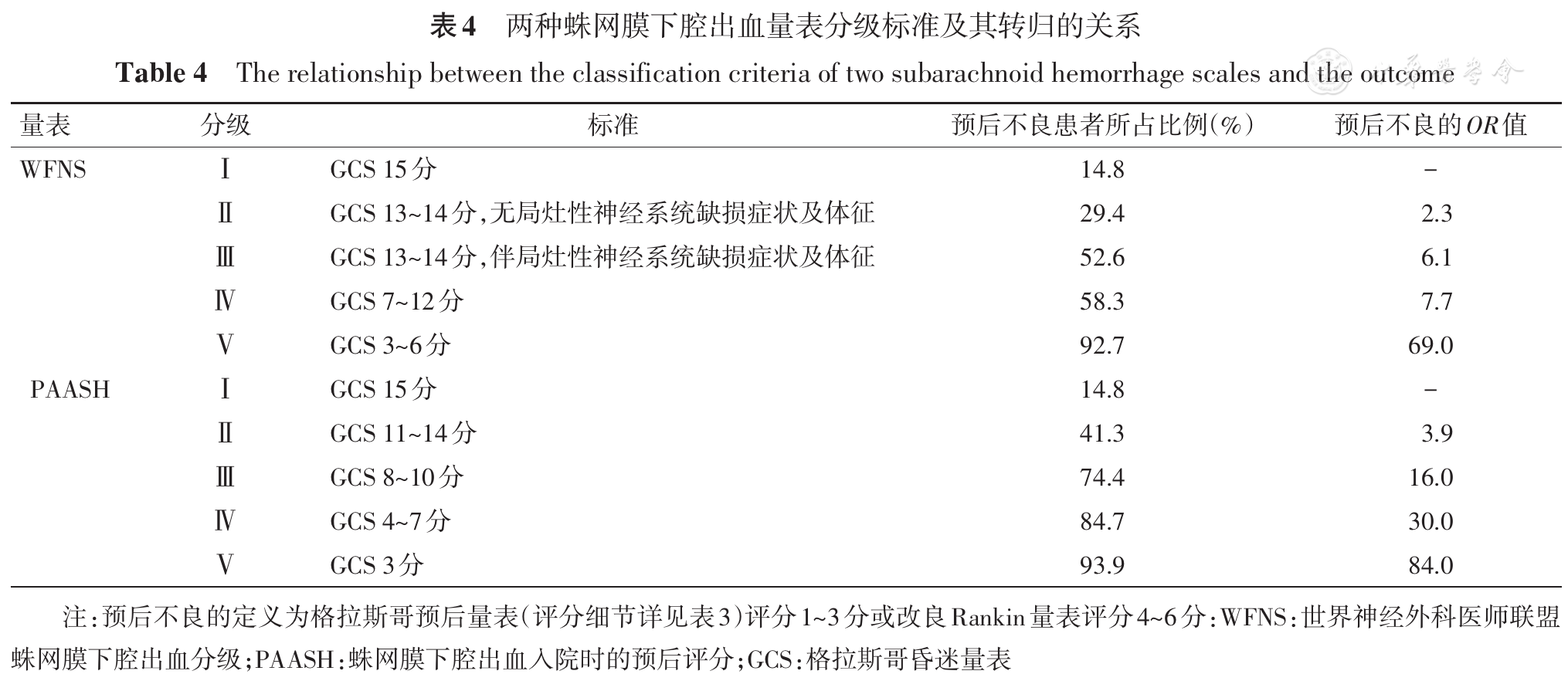
SAH患者可出现呼吸、体温、血压和血糖异常、心电改变、电解质紊乱及其他影响预后的并发症,因此,对患者密切的监测和及时的治疗是必要的。
气道梗阻在SAH患者中不常出现,一旦出现其后果严重,因此呼吸监护是治疗方案的重要部分。应保持气道通畅,必要时予吸氧。呼吸功能障碍明显的患者,必要时可行气管插管或气管切开术辅助通气,并通过血气分析等检查监测血氧饱和度等重要指标[7]。
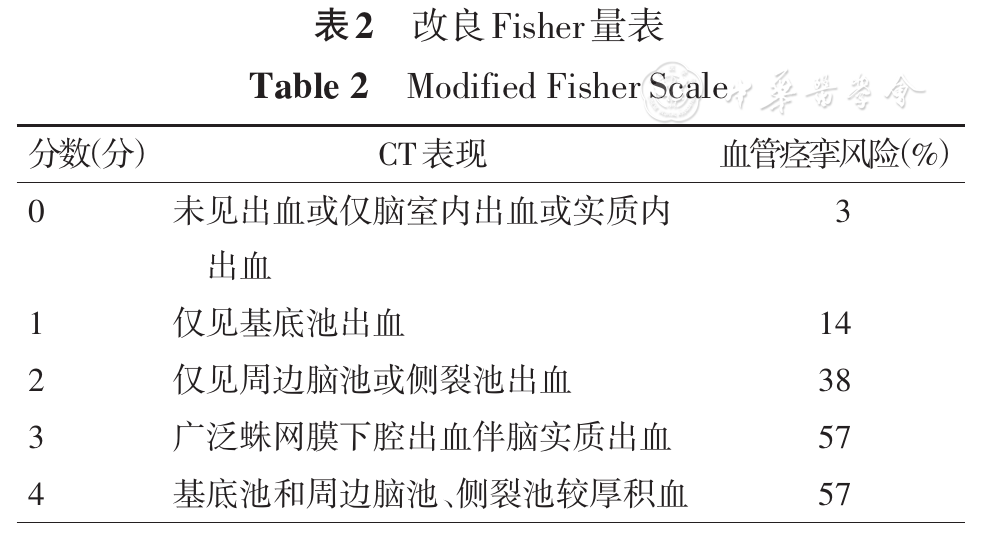
发热与患者的预后不良有关。亚低温治疗可能改善预后,继2005年IHAST研究显示WFNS分级Ⅰ~Ⅲ级的患者术中低温不能较术中正常体温改善SAH患者的神经功能预后[49],有关亚低温的研究仍在不断开展。2017年的一项小样本的单中心随机对照研究显示,术后亚低温治疗可能改善评分不良(Hunt-Hess量表4~5分以及改良Fisher量表3~4分)的SAH患者的神经功能结局和降低病死率[50]。目前的研究尚不足以证明亚低温治疗的临床疗效,其可行性和安全性仍需进一步的研究证实。
动脉瘤再出血后病死率和致残率极高。有研究显示,收缩压>160 mmHg(1 mmHg=0.133 kPa)与动脉瘤再出血相关[7]。因而对于aSAH患者来说,采取积极降压治疗似乎是合理的。但有研究指出,对aSAH患者进行积极降压治疗以降低再出血风险的同时,会增加继发性脑缺血的风险[51]。由于目前尚无aSAH后控制血压对预后影响的随机对照试验或病例对照研究,对于aSAH患者高血压的降压治疗一直存在很大争议。临床上可用于静脉滴注的降压药物有很多,结果各不相同,与拉贝洛尔[52]和硝普钠[53]相比,尼卡地平似乎更能平稳控制血压,但仍缺乏该药与SAH预后相关的临床资料[54]。虽然降低脑灌注压的同时可能会导致脑缺血,但是也有研究表明在SAH等急性脑疾病的患者中尼卡地平的应用不影响脑组织氧分压[55,56]。综上所述,血压管理与SAH患者的预后关系尚不明确,目标血压及降压药物选择尚无统一标准,因此需个体化、综合评估患者病情再确定具体控制血压方案。对于非动脉瘤性SAH的血压管理,目前仍缺乏相关研究证据。
临床研究显示约1/3的SAH患者可发生高血糖,血糖升高是转归不良的独立危险因素[8]。一项纳入17个研究(n=4 095)的荟萃分析[57]指出aSAH后血糖增高与临床预后不良风险增加有关。其他相关研究指出严格控制血糖可改善预后,建议空腹血糖应控制在10 mmol/L以下,但血糖过低亦可导致病死率增加[58,59,60,61]。
SAH患者存在神经源性心肌损伤,这可能与急性脑损伤后交感神经系统激活有关[62]。另外心电异常改变(如心动过缓、相对性心动过速、非特异性ST和T波异常)与SAH的3个月病死率密切相关[63]。因此,在SAH患者的管理过程中,通过心电监测及时发现患者心脏电生理的变化尤为重要,必要时还可根据患者病情检测心肌酶、肌钙蛋白、脑利钠肽等指标进一步评估病情以指导治疗。
尿排钠增多常引起aSAH患者的低钠血症,还可因渗透性利尿降低血容量而导致症状性脑血管痉挛(symptomatic cerebral vasospasm,SCV)、加重脑水肿、升高颅内压、增加癫痫发作和神经损害;另一方面,由于aSAH患者常需要高渗液体治疗来控制颅内压,且有研究表明高钠血症的aSAH患者预后比低钠血症的更差,所以应积极治疗低钠血症和高钠血症。现有研究认为氢化可的松可能有助于预防低钠血症[64],但该研究与另一项Cochrane系统评价均不支持类固醇可改善患者预后[65]。
部分SAH患者在病程中会出现贫血,并可能因为脑血流量和氧输送受限导致DCI。为进一步调查贫血与DCI患病率的关系,有研究对27篇(共4 394例患者)关于SAH患者贫血和输血的原始研究文献进行分析,发现约50%的SAH患者发病后合并贫血,且多在发病后3 d内出现。红细胞输注对脑生理功能有积极作用,但可能与SAH后的并发症、感染、血管痉挛、预后不良等有关,由于纳入的研究缺乏随机对照试验,输血能否改善患者预后仍无定论[66]。
癫痫及DCI是SAH患者常见的严重并发症,其中非惊厥性癫痫持续状态与高病死率、高DCI发生率相关,需严密监测,积极诊疗。有病例对照研究指出连续动态的脑电监测能及时识别更多的癫痫亚临床发作,并可能提前数小时预测DCI[67]。但由于各地连续脑电图监测方法学和判读质量存在差异,连续脑电监测诊断癫痫的准确性和评估预后的价值仍有待前瞻性随机对照试验进一步验证。
推荐意见:(1)注意保持呼吸道通畅(Ⅰ级推荐,B级证据)。(2)注意监测血压,保持在收缩压<160 mmHg和平均动脉压>90 mmHg(Ⅰ级推荐,C级证据)。(3)重视心电监护,采取积极的预防措施,保护心功能(Ⅱ级推荐,B级证据)。(4)注意诊治低钠血症(Ⅰ级推荐,B级证据)。(5)空腹血糖需控制在10 mmol/L以下,同时应避免低血糖(Ⅱ级推荐,C级证据)。(6)发热时予对症处理,但是亚低温(33 ℃)治疗存在争议(Ⅱ级推荐,B级证据)。(7)连续脑电监测有助于预测迟发性脑缺血发生(Ⅲ级推荐,C级证据)。
国际蛛网膜下腔出血动脉瘤试验[68](International Subarachnoid Aneurysm Trail,ISAT)对2 106例aSAH患者治疗时机选择与预后的关系进行研究发现:SAH发病10 d内进行治疗(栓塞或夹闭)的患者,其DCI发生率和临床结局均优于≥11 d开始治疗者。不管选择哪种动脉瘤治疗方式,对有条件在5~10 d内治疗的aSAH患者,均不建议推迟治疗时间。另外,破裂bAVM再出血风险以及致残率和病死率较高,也应早期积极治疗[69]。
动脉瘤治疗的目标包括尽可能完全阻断瘤内血流、防止动脉瘤复发及减少并发症以改善预后。
动脉瘤血管内治疗主要包括两类:其中一类为动脉瘤栓塞术,即通过在动脉瘤内释放弹簧圈致局部血栓形成从而将动脉瘤与循环阻隔,该类治疗手段主要包括单纯弹簧圈动脉瘤栓塞术、支架辅助弹簧圈动脉瘤栓塞术、球囊辅助弹簧圈动脉瘤栓塞术等;另一类为血流导向装置(flow diverter,FD)置入术,即通过置入覆膜或密网孔的血流导向装置,使动脉瘤瘤体内血液淤滞,形成血栓而使动脉瘤闭塞。
动脉瘤夹闭术是指通过外科手术的方式,充分暴露经影像检查明确位置的破裂动脉瘤,使用夹持装置夹闭瘤颈,从而达到阻断瘤内血流的目的。
临床医生在为具体患者制定个性化的最佳治疗方案时,需综合考虑各治疗方式的特点、患者年龄、一般情况、动脉瘤特点(位置、形态以及载瘤血管弯曲度和邻近的重要分支等)及治疗机构等因素。
动脉瘤栓塞术及夹闭术的选择及治疗结局对比一直是神经科学领域研究的热点。
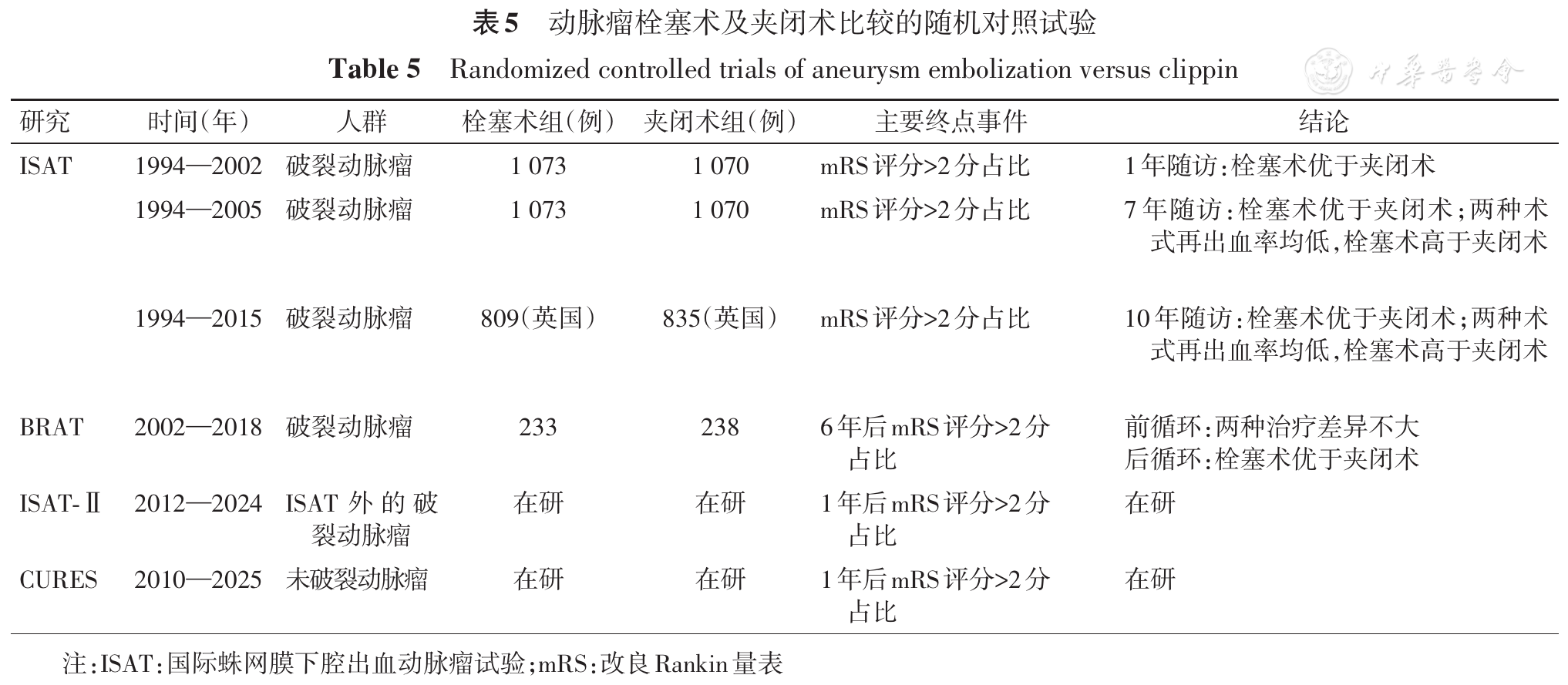
ISAT(International Subarachnoid Aneurysm Trail)和BRAT(Barrow Ruptured Aneurysm Trial)是两项国际大型多中心随机对照试验,均旨在比较动脉瘤夹闭术和栓塞术治疗aSAH的安全性和有效性。
ISAT纳入了2 143例aSAH患者,随机分配到栓塞术组(1 073例)及夹闭术组(1 070例)进行治疗,并对患者进行连续随访。其5年随访数据显示,栓塞组病死率为11%(112/1 046),显著低于夹闭组的14%(144/1 041),但两组存活者中能独立生活的患者比例没有差异(栓塞组83%,夹闭组82%)[70]。此外,对其中英国队列10年随访的数据显示,栓塞组及夹闭组的病死率分别为17%、21%(135/809、178/835),栓塞组的病死率显著低于夹闭组;两组间独立生活率无明显差异(82%与78%),但致死、致残率夹闭组高于栓塞组(22%与18%)。此外,33例患者在首次出血1年多后出现复发性SAH(17例为责任动脉瘤:栓塞组14例,夹闭组3例;16例为非责任动脉瘤),该数据提示栓塞组再出血风险似乎高于外科夹闭组,但该风险很小,且再出血患者中栓塞组的预后较夹闭组好[71]。
BRAT将SAH患者随机分配到栓塞术组(233例)及夹闭术组(238例),其6年随访数据显示,在动脉瘤闭塞率的比较上,夹闭组高于栓塞组。但尽管栓塞组再治疗率高于夹闭组,该研究6年随访中也未发现患者栓塞术后再出血。接受上述两种方式治疗的前循环动脉瘤患者预后相似,但后循环动脉瘤患者栓塞治疗优于夹闭治疗[72]。
FD于2008年被首次报道用于治疗颅内动脉瘤,并逐渐成为治疗复杂动脉瘤的重要治疗方法。近年来,关于FD的临床研究及应用正逐步开展,FD中的PED装置(pipeline embolization device)受到国内外研究者的广泛关注。一项基于2个前瞻性队列研究、1个回顾病例对照研究的荟萃分析(n=1 092)显示[73],患者(共1 221个颅内动脉瘤)使用PED治疗的1年治愈率为85.5%,再治疗率为3%。使用传统材料栓塞的动脉瘤,随着时间的延长,其复发率和再治疗率增加。得益于其密网设计,接受PED治疗的动脉瘤治愈率随着时间延长逐渐提高,长期随访的数据也证明了这一点。由于PED需要特殊的释放技术和操作经验,早期报道的并发症发生率高于传统治疗方法。但随着经验积累,其疗效和安全性亦得到进一步提高。与常规介入栓塞动脉瘤的材料比较,PED的优势尚需要更有循证医学价值的前瞻性随机对照研究证实。
全球第一项比较FD与传统方法治疗颅内动脉瘤的随机对照研究FIAT(flow diversion in the treatment of intracranial aneurysm trial)因安全性问题被提前终止。新的前瞻性研究如PREMIER (prospective study on embolization of intracranial aneurysms with pipeline embolization device)等值得我们期待[74]。
新型栓塞材料的相关研究也在不断开展。前瞻性多中心随机对照研究HELPS (HydroCoil Endovascular Aneurysm Occlusion and Packing study)纳入了499例患者,结果提示水凝胶弹簧圈与传统的裸铂弹簧圈相比降低了动脉瘤的复发,但似乎可能增加脑积水的风险[75]。此外关于Cerecyte弹簧圈[76]、Matrix2弹簧圈[77]与传统的裸铂弹簧圈对比的研究均提示相似的复发率和再治疗率。另一项AMERICA试验提示Axium MicroFX PGLA弹簧圈在颅内动脉瘤治疗中是安全有效的[78]。总的来说,目前尚无足够的证据证实新材料显著优于其他常规材料。
目前,未破裂bAVM是否需要治疗仍存争议。2013年针对未破裂颅内动静脉畸形的随机对照试验(A Randomized Trial of Unruptured Brain Arteriovenous Malformations,ARUBA)结果提示,对于未破裂bAVM,内科治疗优于干预性治疗[79]。但此后的多项研究发现,干预性治疗效果优于保守及内科治疗[80,81,82]。bAVM破裂可引起SAH、脑室内出血、脑实质出血。破裂bAVM再出血致残率和致死率较高,应给予积极治疗[83]。治疗的首要目标是完全消除畸形血管团[74,84]。对bAVM目前有3种主要的治疗方式,3种方式各有特点,临床医生应当结合患者具体病情,选择合适的治疗策略。
外科切除术可以完全消除畸形血管、立即消除出血风险并避免复发,其缺点在于创伤大、康复时间长且可引起神经功能缺损。
SRS主要是利用立体定向技术,对颅内靶点精确定位,将单次大剂量射线集中照射于靶组织,使之产生局灶性坏死,从而达到类似手术的效果。其治疗机制是促使血管内皮细胞增殖,血管壁进行性向心性增厚,最终造成管腔闭塞[45]。单独采用SRS再出血风险大[45]。此外,对辐射引起的不良反应也应加以考虑。
血管内治疗策略包括:术前栓塞、完全性栓塞、SRS治疗前栓塞、靶向栓塞和姑息性栓塞。
对于无法立即外科切除的破裂bAVM,术前栓塞不仅可以快速降低出血风险,为手术争取时间,还能栓塞深部血管,减小血管团体积,从而降低手术难度和风险,减少相关并发症[85,86]。
完全性栓塞创伤小,但存在复发、再出血的风险。有回顾性研究显示,对于最大直径<3 cm的bAVM、单一动脉供血和单一动静脉瘘的完全栓塞率达70%[87]。
对已破裂bAVM难以手术切除及完全栓塞时,可考虑部分栓塞+SRS的治疗策略,但有研究显示,栓塞可能降低SRS对bAVM的消除率[88,89,90]。
指选择性处理破裂血管和有动脉瘤、动静脉瘘的高危血管,在无法切除或完全栓塞的情况下降低出血及再出血的风险。
采用选择性栓塞高流量供血动脉从而减轻神经功能缺损症状的方法。有小样本的研究结果支持降低血流量可以改善患者生存质量,可作为处理破裂血管后的一种补充治疗。
bAVM介入治疗常用的栓塞材料包括固体栓塞材料(弹簧圈、球囊、聚乙烯醇粒子和线圈等)和液体栓塞剂(NBCA胶和Onyx胶等);常用的手术入路包括动脉入路和静脉入路[37]。神经介入医师可根据治疗目的、血管解剖、材料特性以及操作的熟悉程度等选择合适的手术入路和栓塞材料。
aSAH患者术中动脉瘤再破裂可以导致病情迅速加重甚至死亡,颅内动脉瘤治疗后再破裂研究(Cerebral Aneurysm Rerupture After Treatment,CARAT)对3年内来自9个美国医疗中心的1 010例aSAH患者进行调查发现,19%的夹闭术患者和5%的栓塞术患者出现了术中再破裂,其围术期死残率分别高达31%和63%[91]。造影过程中发现瘤周造影剂外渗是较可靠的征象。该并发症应以预防为主,充分的术前准备和熟练的手术操作可能减少动脉瘤再破裂的发生。目前针对动脉瘤再破裂,临床上常用方法包括立即栓塞或外科夹闭,同时围手术期积极治疗血管痉挛和颅内压增高,必要时予脑脊液引流或手术清除血肿等,但上述处置方式尚无统一标准。
血管内操作、支架辅助栓塞以及FD置入均可导致血栓形成,因此,围手术期抗血小板治疗是必要的。有研究表明,与氯吡格雷敏感者相比,氯吡格雷抵抗者PED术后发生血栓栓塞的概率明显更高;氯吡格雷抵抗者术前24 h内服用替格瑞洛或增加氯吡格雷用量可降低血栓风险[92]。
栓塞术过程中弹簧圈或其辅助支架移位是罕见的并发症,重在预防。研究发现,在血管弯曲部位行弹簧圈栓塞术时,辅助支架贴壁不全与支架成角大、曲率半径小、血管管径大相关,与支架长度或固定的直径无明显相关性[93],医生在操作时应综合考虑上述因素。
SAH后是否应用止血药物存在争议,现有研究提示抗纤溶药物的使用利弊并存。早期、短时间使用氨基己酸可显著降低SAH患者的再出血发生率并改善其3个月时的临床预后,且使用氨基己酸治疗的患者在造影过程中均未发现脑血栓形成,但其下肢深静脉血栓形成的风险相对增高,尤其是对于有既往深静脉血栓形成病史的患者[94]。一项基于10个随机对照试验(n=1 904)的Cochrane系统评价结果显示,现有证据不支持抗纤溶药物治疗SAH,短期使用可能是有效的,但仍需临床试验评估其有效性[95]。美国食品药品管理局并未批准使用氨甲环酸和氨基己酸预防动脉瘤再出血[96]。其他治疗还包括卧床休息、止痛、适当镇静、通便、平稳调控血压等[7]。
脑血管造影检查发现有近2/3的SAH患者发生脑血管痉挛,约半数患者可以没有症状。血管痉挛常在动脉瘤破裂后3~4 d内出现,7~10 d达到高峰,14~21 d逐渐缓解。脑大动脉痉挛的严重程度与神经功能缺损严重程度呈正相关,微小的脑血管痉挛患者不但会出现临床症状,甚至会进展为脑梗死。脑血管造影是诊断脑血管痉挛的"金标准"。一项基于17个研究(n=2 870)的系统评价指出经颅多普勒(transcranial Doppler,TCD)诊断血管痉挛具有高敏感度和阴性预测值,是理想的监测设备[97]。
DCI通常被定义为一种局灶性神经功能缺损综合征[98],一直被认为是导致aSAH患者死亡和残疾的主要原因之一。DCI的主要病因是血管痉挛,此外,微循环痉挛、微血栓、皮质扩散去极化及脑自主调节障碍等因素亦被认为与DCI的发生有关。DCI可发生于近1/3的SAH患者,且好发于动脉瘤破裂后3~14 d[99]。TCD对DCI具有较高预测价值,一个纳入15项研究(n=5 463)的荟萃分析指出TCD较脑血管造影具有更高的诊断敏感度、特异度和阴性预测值,能更好地识别血管痉挛及预测DCI[100]。除TCD外,CTA、CTP检查虽能更清晰准确地显示血管结构和低灌注区域,有助于明确DCI的诊断,但因需使用肾毒性对比剂、反复搬动转运患者等因素限制了其临床的应用[101]。
国内外大多数指南均推荐使用尼莫地平治疗血管痉挛以改善aSAH患者的预后(口服,60 mg,1次/4 h,3周)[102]。但使用尼莫地平后未在患者的血管造影中显示明确血管扩张效果,其改善预后的机制尚不清楚。其他钙离子拮抗剂如尼卡地平针对血管痉挛的防治无确切疗效[53]。CONSCIOUS-3试验[103]主要评估克拉生坦能否降低栓塞术后血管痉挛相关的发生率和全因病死率,该研究指出克拉生坦(15 mg/h)可降低术后血管痉挛相关的发生率/全因病死率。既往研究指出他汀类药物可能降低脑血管痉挛的发生,但最近一项基于4项随机安慰剂对照试验(n=190)的系统评价结果提示他汀类药物对aSAH患者的有效性有待进一步研究明确[104]。镁治疗[9]未能降低DCI的风险。内皮素-1在血管痉挛的发生过程中起着重要的调节作用,虽理论上可能可以减少血管痉挛的发生,但目前没有证据表明其能改善预后[105]。
既往治疗血管痉挛主要使用血液稀释、高血压、高血容量方法(3 H疗法),但进一步的观察发现等容量、高血压方法似乎更为有效[7]。升血压治疗一直被应用于治疗aSAH DCI,但文献报道其有效性仅基于未设置对照组的病例。最新的采用诱导升血压治疗SAH后DCI的随机对照试验结果提示,尚无任何证据支持诱导性升压有效,也没有证据表明这种治疗方式可导致严重的不良事件[106],应慎重抉择。
脑积水是SAH常见的严重并发症,临床表现为急性颅内压增高、脑干受压、脑疝等,CT检查提示脑室系统阻塞的相关表现。根据脑积水的发病情况可分为急性脑积水(发病3 d)、亚急性脑积水(4~14 d)、慢性脑积水(2周后)。最新研究显示,SAH患者脑积水的发生率为20%~30%,其中早期脑积水(急性期、亚急性期)发生率为20%,而慢性期脑积水发生率为10%~20%[107]。1/3脑积水患者可无明显的症状,约1/2的患者在24 h内脑积水可自行缓解[8]。因此,许多神经外科医生不推荐对急性脑积水患者立即采取脑室外引流治疗。但对脑积水仍应及时诊治,进展性脑积水可导致神经功能缺损、病情恶化甚至有脑疝形成的风险。
目前,对aSAH相关性脑积水的治疗缺乏大量证据支持。但如果脑积水导致病情恶化或有脑疝风险,需要尽快行脑室外引流或者腰椎穿刺放液治疗。回顾性病例系列研究报道腰大池引流治疗aSAH相关性脑积水是安全的,且不增加再出血风险[96]。
纳入471例SAH患者的随机对照试验显示,经血管内治疗及外科手术夹闭治疗的aSAH患者发生分流依赖性脑积水的概率并无显著差异[108]。针对慢性aSAH相关性脑积水患者,临床上通常采用永久性分流术(包括脑室分流术、脑室腹膜分流术及椎管腹膜分流术等)进行治疗[7,9]。该类手术主要适用于年龄较大、早期脑室扩大、脑室内出血、临床情况差的患者以及女性患者。
对于颅内压升高的患者,还可以使用渗透性脱水剂(如甘露醇、高渗盐水、甘油果糖等)治疗,同时血浆渗透压应维持在300~320 mOsm/kg。如果颅内压仍高于20 mmHg,可以使用止痛和镇静治疗,如异丙酚、依托咪酯、咪达唑仑、吗啡、阿芬他尼,或者使用神经肌肉阻滞剂治疗[7]。
据报道,aSAH后急性癫痫的发生率约为6%~26%[109],两项回顾性研究结果显示,aSAH后非惊厥癫痫持续状态是临床预后不良的最主要预测因子[110,111]。有研究表明,aSAH患者院前癫痫发作的比例为17.9%,院内发作占4.1%[112]。术后即刻发作的发生率约为2.3%,迟发性癫痫的发生率约为5.5%[113]。ISAT结果显示:手术夹闭组癫痫发作发生率(13.6%)显著高于血管内弹簧栓塞治疗(8.3%)[114]。另一项纳入3 552例患者的随机双盲安慰剂对照试验则显示,接受预防性抗癫痫治疗者的临床转归比未接受预防性抗癫痫治疗者更差[115]。目前是否在SAH患者中预防性使用抗癫痫药物存在争议,抗癫痫药物的应用可能继发不同程度的药物不良反应,需权衡预防性用药可能的益处和潜在的风险。
[1] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志, 2018, 51(9): 666-682.
[2] Rincon F, Rossenwasser RH, Dumont A. The epidemiology of admissions of nontraumatic subarachnoid hemorrhage in the United States[J]. Neurosurgery, 2013, 73(2): 217-222;
[3] Ingall T, Asplund K, Mahonen M, et al. A multinational comparison of subarachnoid hemorrhage epidemiology in the WHO MONICA stroke study[J]. Stroke, 2000, 31(5): 1054-1061.
[4] De Rooij NK, Linn FH, Van Der Plas JA, et al. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends[J]. J Neurol Neurosurg Psychiatry, 2007, 78(12): 1365-1372.
[5] Qureshi AI, Malik AA, Saeed O, et al. Hormone replacement therapy and the risk of subarachnoid hemorrhage in postmenopausal women[J]. J Neurosurg, 2016, 124(1): 45-50.
[6] Jordan LC, Johnston SC, Wu YW, et al. The importance of cerebral aneurysms in childhood hemorrhagic stroke: a population-based study[J]. Stroke, 2009, 40(2): 400-405.
[7] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国蛛网膜下腔出血诊治指南2015[J].中华神经科杂志, 2016, 49(3): 182-191.
[8] Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage[J]. Cerebrovasc Dis, 2013, 35(2): 93-112.
[9] Connolly ES,
[10] Mackey J, Khoury JC, Alwell K, et al. Stable incidence but declining case-fatality rates of subarachnoid hemorrhage in a population[J]. Neurology, 2016, 87(21): 2192-2197.
[11] Cross DT 3rd, Tirschwell DL, Clark MA, et al. Mortality rates after subarachnoid hemorrhage: variations according to hospital case volume in 18 states[J]. J Neurosurg, 2003, 99(5): 810-817.
[12] Farhat HI. Cerebral arteriovenous malformations[J]. Dis Mon, 2011, 57(10): 625-637.
[13] Juvela S, Hillbom M, Numminen H, et al. Cigarette smoking and alcohol consumption as risk factors for aneurysmal subarachnoid hemorrhage[J]. Stroke, 1993, 24(5): 639-646.
[14] Longstreth WT,
[15] Ruigrok YM, Buskens E, Rinkel GJ. Attributable risk of common and rare determinants of subarachnoid hemorrhage[J]. Stroke, 2001, 32(5): 1173-1175.
[16] Feigin VL, Rinkel GJ, Lawes CM, et al. Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies[J]. Stroke, 2005, 36(12): 2773-2780.
[17] Bonita R. Cigarette smoking, hypertension and the risk of subarachnoid hemorrhage: a population-based case-control study[J]. Stroke, 1986, 17(5): 831-835.
[18] Kojima M, Nagasawa S, Lee YE, et al. Asymptomatic familial cerebral aneurysms[J]. Neurosurgery, 1998, 43(4): 776-781.
[19] Chang TR, Kowalski RG, Caserta F, et al. Impact of acute cocaine use on aneurysmal subarachnoid hemorrhage[J]. Stroke, 2013, 44(7): 1825-1829.
[20] Broderick JP, Viscoli CM, Brott T, et al. Major risk factors for aneurysmal subarachnoid hemorrhage in the young are modifiable[J]. Stroke, 2003, 34(6): 1375-1381.
[21] Ducros A, Bousser MG. Thunderclap headache[J]. BMJ, 2013, 346: e8557.
[22] Kowalski RG, Claassen J, Kreiter KT, et al. Initial misdiagnosis and outcome after subarachnoid hemorrhage[J]. JAMA, 2004, 291(7): 866-869.
[23] Edlow JA. Diagnosis of subarachnoid hemorrhage[J]. Neurocrit Care, 2005, 2(2): 99-109.
[24] Edlow JA. Diagnosing headache in the emergency department: what is more important? Being right, or not being wrong?[J]. Eur J Neurol, 2008, 15(12): 1257-1258.
[25] Jakobsson KE, Saveland H, Hillman J, et al. Warning leak and management outcome in aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 1996, 85(6): 995-999.
[26] Dubosh NM, Bellolio MF, Rabinstein AA, et al. Sensitivity of early brain computed tomography to exclude aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis[J]. Stroke, 2016, 47(3): 750-755.
[27] Perry JJ, Stiell IG, Sivilotti ML, et al. Sensitivity of computed tomography performed within six hours of onset of headache for diagnosis of subarachnoid haemorrhage: prospective cohort study[J]. BMJ, 2011, 343: d4277.
[28] Delgado Almandoz JE, Schaefer PW, Forero NP, et al. Diagnostic accuracy and yield of multidetector CT angiography in the evaluation of spontaneous intraparenchymal cerebral hemorrhage[J]. AJNR Am J Neuroradiol, 2009, 30(6): 1213-1221.
[29] Westerlaan HE, van Dijk JM, Jansen-van der Weide MC, et al. Intracranial aneurysms in patients with subarachnoid hemorrhage: CT angiography as a primary examination tool for diagnosis-systematic review and meta-analysis[J]. Radiology, 2011, 258(1): 134-145.
[30] Philipp LR, Mccracken DJ, Mccracken CE, et al. Comparison between CTA and digital subtraction angiography in the diagnosis of ruptured aneurysms[J]. Neurosurgery, 2017, 80(5): 769-777.
[31] Bechan RS, Van Rooij SB, Sprengers ME, et al. CT angiography versus 3D rotational angiography in patients with subarachnoid hemorrhage[J]. Neuroradiology, 2015, 57(12): 1239-1246.
[32] Agid R, Andersson T, Almqvist H, et al. Negative CT angiography findings in patients with spontaneous subarachnoid hemorrhage: When is digital subtraction angiography still needed?[J]. AJNR Am J Neuroradiol, 2010, 31(4): 696-705.
[33] Gordhan A. Vascular anomaly at the craniocervical junction presenting with subarachnoid hemorrhage: dilemma in imaging diagnosis, endovascular management and complications[J]. J Radiol Case Rep, 2010, 4(5): 1-6.
[34] Zeiler FA, Mcdonald PJ, Kaufmann A, et al. Gamma knife for cerebral arteriovenous malformations at a single centre[J]. Can J Neurol Sci, 2011, 38(6): 851-857.
[35] Kidwell CS, Wintermark M. Imaging of intracranial haemorrhage[J]. Lancet Neurol, 2008, 7(3): 256-267.
[36] Haifeng L, Yongsheng X, Yangqin X, et al. Diagnostic value of 3D time-of-flight magnetic resonance angiography for detecting intracranial aneurysm: a meta-analysis[J]. Neuroradiology, 2017, 59(11): 1083-1092.
[37] 中华医学会神经外科学分会介入学组,《脑动静脉畸形介入治疗中国专家共识》编写委员会.脑动静脉畸形介入治疗中国专家共识[J].中华神经外科杂志, 2017, 33(12): 1195-1203.
[38] Hadizadeh DR, Kukuk GM, Steck DT, et al. Noninvasive evaluation of cerebral arteriovenous malformations by 4D-MRA for preoperative planning and postoperative follow-up in 56 patients: comparison with DSA and intraoperative findings[J]. AJNR Am J Neuroradiol, 2012, 33(6): 1095-1101.
[39] Gross BA, Frerichs KU, Du R. Sensitivity of CT angiography, T2-weighted MRI, and magnetic resonance angiography in detecting cerebral arteriovenous malformations and associated aneurysms[J]. J Clin Neurosci, 2012, 19(8): 1093-1095.
[40] Machet A, Portefaix C, Kadziolka K, et al. Brain arteriovenous malformation diagnosis: value of time-resolved contrast-enhanced MR angiography at 3.0T compared to DSA[J]. Neuroradiology, 2012, 54(10): 1099-1108.
[41] Delgado Almandoz JE, Kadkhodayan Y, Crandall BM, et al. Diagnostic yield of delayed neurovascular imaging in patients with subarachnoid hemorrhage, negative initial CT and catheter angiograms, and a negative 7 day repeat catheter angiogram[J]. J Neurointerv Surg, 2014, 6(8): 637-642.
[42] Delgado Almandoz JE, Jagadeesan BD, Refai D, et al. Diagnostic yield of repeat catheter angiography in patients with catheter and computed tomography angiography negative subarachnoid hemorrhage[J]. Neurosurgery, 2012, 70(5): 1135-1142.
[43] Dalyai R, Chalouhi N, Theofanis T, et al. Subarachnoid hemorrhage with negative initial catheter angiography: a review of 254 cases evaluating patient clinical outcome and efficacy of short- and long-term repeat angiography[J]. Neurosurgery, 2013, 72(4): 646-652;
[44] Van Asch CJ, Velthuis BK, Rinkel GJ, et al. Diagnostic yield and accuracy of CT angiography, MR angiography, and digital subtraction angiography for detection of macrovascular causes of intracerebral haemorrhage: prospective, multicentre cohort study[J]. BMJ, 2015, 351: h5762.
[45] Derdeyn CP, Zipfel GJ, Albuquerque FC, et al. Management of brain arteriovenous malformations: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2017, 48(8): e200-224.
[46] Zhang L, Zhang B, Qi S. Impact of echocardiographic wall motion abnormality and cardiac biomarker elevation on outcome after subarachnoid hemorrhage: a meta-analysis[J]. Neurosurg Rev, 2018
[47] Chen WL, Huang CH, Chen JH, et al. ECG abnormalities predict neurogenic pulmonary edema in patients with subarachnoid hemorrhage[J]. Am J Emerg Med, 2016, 34(1): 79-82.
[48] Macdonald RL, Schweizer TA. Spontaneous subarachnoid haemorrhage[J]. Lancet, 2017, 389(10069): 655-666.
[49] Todd MM, Hindman BJ, Clarke WR, et al. Mild intraoperative hypothermia during surgery for intracranial aneurysm[J]. N Engl J Med, 2005, 352(2): 135-145.
[50] Choi W, Kwon SC, Lee WJ, et al. Feasibility and safety of mild therapeutic hypothermia in poor-grade subarachnoid hemorrhage: prospective pilot study[J]. J Korean Med Sci, 2017, 32(8): 1337-1344.
[51] Wijdicks EF, Vermeulen M, Murray GD, et al. The effects of treating hypertension following aneurysmal subarachnoid hemorrhage[J]. Clin Neurol Neurosurg, 1990, 92(2): 111-117.
[52] Liu-Deryke X, Janisse J, Coplin WM, et al. A comparison of nicardipine and labetalol for acute hypertension management following stroke[J]. Neurocrit Care, 2008, 9(2): 167-176.
[53] Roitberg BZ, Hardman J, Urbaniak K, et al. Prospective randomized comparison of safety and efficacy of nicardipine and nitroprusside drip for control of hypertension in the neurosurgical intensive care unit[J]. Neurosurgery, 2008, 63 (1): 115-120;
[54] Kim SY, Kim SM, Park MS, et al. Effectiveness of nicardipine for blood pressure control in patients with subarachnoid hemorrhage[J]. J Cerebrovasc Endovasc Neurosurg, 2012, 14(2): 84-89.
[55] Velthuis BK, Rinkel GJ, Ramos LM, et al. Perimesencephalic hemorrhage. Exclusion of vertebrobasilar aneurysms with CT angiography[J]. Stroke, 1999, 30(5): 1103-1109.
[56] Narotam PK, Puri V, Roberts JM, et al. Management of hypertensive emergencies in acute brain disease: evaluation of the treatment effects of intravenous nicardipine on cerebral oxygenation[J]. J Neurosurg, 2008, 109(6): 1065-1074.
[57] Kruyt ND, Biessels GJ, De Haan RJ, et al. Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis[J]. Stroke, 2009, 40(6): e424-430.
[58] Bilotta F, Spinelli A, Giovannini F, et al. The effect of intensive insulin therapy on infection rate, vasospasm, neurologic outcome, and mortality in neurointensive care unit after intracranial aneurysm clipping in patients with acute subarachnoid hemorrhage: a randomized prospective pilot trial[J]. J Neurosurg Anesthesiol, 2007, 19(3): 156-160.
[59] Latorre JG, Chou SH, Nogueira RG, et al. Effective glycemic control with aggressive hyperglycemia management is associated with improved outcome in aneurysmal subarachnoid hemorrhage[J]. Stroke, 2009, 40(5): 1644-1652.
[60] Naidech AM, Levasseur K, Liebling S, et al. Moderate hypoglycemia is associated with vasospasm, cerebral infarction, and 3-month disability after subarachnoid hemorrhage[J]. Neurocrit Care, 2010, 12(2): 181-187.
[61] Thiele RH, Pouratian N, Zuo Z, et al. Strict glucose control does not affect mortality after aneurysmal subarachnoid hemorrhage[J]. Anesthesiology, 2009, 110(3): 603-610.
[62] Fletcher JJ, Meurer W, Dunne M, et al. Inter-observer agreement on the diagnosis of neurocardiogenic injury following aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2014, 20(2): 263-269.
[63] Coghlan LA, Hindman BJ, Bayman EO, et al. Independent associations between electrocardiographic abnormalities and outcomes in patients with aneurysmal subarachnoid hemorrhage: findings from the intraoperative hypothermia aneurysm surgery trial[J]. Stroke, 2009, 40(2): 412-418.
[64] Katayama Y, Haraoka J, Hirabayashi H, et al. A randomized controlled trial of hydrocortisone against hyponatremia in patients with aneurysmal subarachnoid hemorrhage[J]. Stroke, 2007, 38(8): 2373-2375.
[65] Feigin VL, Anderson N, Rinkel GJ, et al. Corticosteroids for aneurysmal subarachnoid haemorrhage and primary intracerebral haemorrhage[J]. Cochrane Database Syst Rev, 2005, (3): Cd004583.
[66] Le Roux PD, Participants in the International Multi-disciplinary Consensus Conference on the Critical Care Management of Subarachnoid Hemorrhage. Anemia and transfusion after subarachnoid hemorrhage[J]. Neurocrit Care, 2011, 15(2): 342-353.
[67] Kondziella D, Friberg CK, Wellwood I, et al. Continuous EEG monitoring in aneurysmal subarachnoid hemorrhage: a systematic review[J]. Neurocrit Care, 2015, 22(3): 450-461.
[68] Dorhout Mees SM, Molyneux AJ, Kerr RS, et al. Timing of aneurysm treatment after subarachnoid hemorrhage: relationship with delayed cerebral ischemia and poor outcome[J]. Stroke, 2012, 43(8): 2126-2129.
[69] Ogilvy CS, Stieg PE, Awad I, et al. Recommendations for the management of intracranial arteriovenous malformations: a statement for healthcare professionals from a special writing group of the Stroke Council, American Stroke Association[J]. Circulation, 2001, 103(21): 2644-2657.
[70] Molyneux AJ, Kerr RS, Birks J, et al. Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up[J]. Lancet Neurol, 2009, 8(5): 427-433.
[71] Molyneux AJ, Birks J, Clarke A, et al. The durability of endovascular coiling versus neurosurgical clipping of ruptured cerebral aneurysms: 18 year follow-up of the UK cohort of the International Subarachnoid Aneurysm Trial (ISAT)[J]. Lancet, 2015, 385(9969): 691-697.
[72] Spetzler RF, Mcdougall CG, Zabramski JM, et al. The Barrow Ruptured Aneurysm Trial: 6-year results[J]. J Neurosurg, 2015, 123(3): 609-617.
[73] Kallmes DF, Brinjikji W, Cekirge S, et al. Safety and efficacy of the Pipeline embolization device for treatment of intracranial aneurysms: a pooled analysis of 3 large studies[J]. J Neurosurg, 2017, 127(4): 775-780.
[74] Eskey CJ, Meyers PM, Nguyen TN, et al. Indications for the performance of intracranial endovascular neurointerventional procedures: a scientific statement from the American Heart Association[J]. Circulation, 2018, 137(21): e661-689.
[75] White PM, Lewis SC, Gholkar A, et al. Hydrogel-coated coils versus bare platinum coils for the endovascular treatment of intracranial aneurysms (HELPS): a randomised controlled trial[J]. Lancet, 2011, 377(9778): 1655-1662.
[76] Molyneux AJ, Clarke A, Sneade M, et al. Cerecyte coil trial: angiographic outcomes of a prospective randomized trial comparing endovascular coiling of cerebral aneurysms with either cerecyte or bare platinum coils[J]. Stroke, 2012, 43(10): 2544-2550.
[77] Youn SW, Cha SH, Kang HS, et al. Matrix2 coils in embolization of intracranial aneurysms: 1-year outcome and comparison with bare platinum coil group in a single institution[J]. AJNR Am J Neuroradiol, 2011, 32(9): 1745-1750.
[78] Fargen KM, Blackburn S, Deshaies EM, et al. Final results of the multicenter, prospective Axium MicroFX for Endovascular Repair of IntraCranial Aneurysm Study (AMERICA)[J]. J Neurointerv Surg, 2015, 7(1): 40-43.
[79] Mohr JP, Parides MK, Stapf C, et al. Medical management with or without interventional therapy for unruptured brain arteriovenous malformations (ARUBA): a multicentre, non-blinded, randomised trial[J]. Lancet, 2014, 383(9917): 614-621.
[80] Wong J, Slomovic A, Ibrahim G, et al. Microsurgery for ARUBA Trial (a randomized trial of unruptured brain arteriovenous malformation)-eligible unruptured brain arteriovenous malformations[J]. Stroke, 2017, 48(1): 136-144.
[81] Ding D, Starke RM, Kano H, et al. Radiosurgery for cerebral arteriovenous malformations in a randomized trial of unruptured brain arteriovenous malformations (ARUBA)-eligible patients: a multicenter study[J]. Stroke, 2016, 47(2): 342-349.
[82] Nerva JD, Mantovani A, Barber J, et al. Treatment outcomes of unruptured arteriovenous malformations with a subgroup analysis of ARUBA (a randomized trial of unruptured brain arteriovenous malformations)-eligible patients[J]. Neurosurgery, 2015, 76(5): 563-570;
[83] Ogilvy CS, Stieg PE, Awad I, et al. Recommendations for the management of intracranial arteriovenous malformations: a statement for healthcare professionals from a special writing group of the Stroke Council, American Stroke Association[J]. Circulation, 2001, 103(21): 2644-2657.
[84] Lv X, Wu Z, Li Y, et al. Hemorrhage risk after partial endovascular NBCA and ONYX embolization for brain arteriovenous malformation[J]. Neurol Res, 2012, 34(6): 552-556.
[85] Consoli A, Scarpini G, Rosi A, et al. Endovascular treatment of unruptured and ruptured brain arteriovenous malformations with Onyx18: a monocentric series of 84 patients[J]. J Neurointerv Surg, 2014, 6(8): 600-606.
[86] Zacharia BE, Vaughan KA, Jacoby A, et al. Management of ruptured brain arteriovenous malformations[J]. Curr Atheroscler Rep, 2012, 14(4): 335-342.
[87] Willinsky R, Goyal M, Terbrugge K, et al. Embolisation of small (<3 cm) brain arteriovenous malformations. Correlation of angiographic results to a proposed angioarchitecture grading system[J]. Interv Neuroradiol, 2001, 7(1): 19-27.
[88] Kano H, Kondziolka D, Flickinger JC, et al. Stereotactic radiosurgery for arteriovenous malformations after embolization: a case-control study[J]. J Neurosurg, 2012, 117(2): 265-275.
[89] Schwyzer L, Yen CP, Evans A, et al. Long-term results of gamma knife surgery for partially embolized arteriovenous malformations[J]. Neurosurgery, 2012, 71(6): 1139-1147;
[90] Andrade-Souza YM, Ramani M, Beachey DJ, et al. Liquid embolisation material reduces the delivered radiation dose: a physical experiment[J]. Acta Neurochir (Wien), 2008, 150(2): 161-164;
[91] Elijovich L, Higashida RT, Lawton MT, et al. Predictors and outcomes of intraprocedural rupture in patients treated for ruptured intracranial aneurysms: the CARAT study[J]. Stroke, 2008, 39(5): 1501-1506.
[92] Adeeb N, Griessenauer CJ, Foreman PM, et al. Use of platelet function testing before pipeline embolization device placement: a multicenter cohort study[J]. Stroke, 2017, 48(5): 1322-1330.
[93] Heller RS, Malek AM. Parent vessel size and curvature strongly influence risk of incomplete stent apposition in enterprise intracranial aneurysm stent coiling[J]. AJNR Am J Neuroradiol, 2011, 32(9): 1714-1720.
[94] Starke RM, Kim GH, Fernandez A, et al. Impact of a protocol for acute antifibrinolytic therapy on aneurysm rebleeding after subarachnoid hemorrhage[J]. Stroke, 2008, 39(9): 2617-2621.
[95] Baharoglu MI, Germans MR, Rinkel GJ, et al. Antifibrinolytic therapy for aneurysmal subarachnoid haemorrhage[J]. Cochrane Database Syst Rev, 2013, (8): Cd001245.
[96] Connolly ES, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2012, 43(6): 1711-1737.
[97] Kumar G, Shahripour RB, Harrigan MR. Vasospasm on transcranial Doppler is predictive of delayed cerebral ischemia in aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis[J]. J Neurosurg, 2016, 124(5): 1257-1264.
[98] Vergouwen MDI, Vermeulen M, Van Gijn J, et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies[J]. Stroke, 2010, 41(10): 2391-2395.
[99] Rowland MJ, Hadjipavlou G, Kelly M, et al. Delayed cerebral ischaemia after subarachnoid haemorrhage: looking beyond vasospasm[J]. Br J Anaesth, 2012, 109(3): 315-329.
[100] Kumar G, Dumitrascu OM, Chiang CC, et al. Prediction of delayed cerebral ischemia with cerebral angiography: a meta-analysis[J]. Neurocrit Care, 2019, 30(1): 62-71.
[101] van der Schaaf I, Wermer MJ, van der Graaf Y, et al. CT after subarachnoid hemorrhage: relation of cerebral perfusion to delayed cerebral ischemia[J]. Neurology, 2006, 66(10): 1533-1538.
[102] Dorhout Mees SM, Rinkel GJ, Feigin VL, et al. Calcium antagonists for aneurysmal subarachnoid haemorrhage[J]. Cochrane Database Syst Rev, 2007, (3): Cd000277.
[103] Macdonald RL, Higashida RT, Keller E, et al. Randomized trial of clazosentan in patients with aneurysmal subarachnoid hemorrhage undergoing endovascular coiling[J]. Stroke, 2012, 43(6): 1463-1469.
[104] Vergouwen MD, de Haan RJ, Vermeulen M, et al. Effect of statin treatment on vasospasm, delayed cerebral ischemia, and functional outcome in patients with aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis update[J]. Stroke, 2010, 41(1): e47-52.
[105] Guo J, Shi Z, Yang K, et al. Endothelin receptor antagonists for subarachnoid hemorrhage[J]. Cochrane Database Syst Rev, 2012, (9): Cd008354.
[106] Gathier CS, van den Bergh WM, van der Jagt M, et al. Induced hypertension for delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage: a randomized clinical trial[J]. Stroke, 2018, 49(1): 76-83.
[107] Chen S, Luo J, Reis C, et al. Hydrocephalus after subarachnoid hemorrhage: pathophysiology, diagnosis, and treatment[J]. 2017, 2017: 8584753.
[108] Zaidi HA, Montoure A, Elhadi A, et al. Long-term functional outcomes and predictors of shunt-dependent hydrocephalus after treatment of ruptured intracranial aneurysms in the BRAT trial: revisiting the clip vs coil debate[J]. Neurosurgery, 2015, 76(5): 608-613;
[109] Allen BB, Forgacs PB, Fakhar MA, et al. Association of seizure occurrence with aneurysm treatment modality in aneurysmal subarachnoid hemorrhage patients[J]. Neurocrit Care, 2018, 29(1): 62-68.
[110] Dennis LJ, Claassen J, Hirsch LJ, et al. Nonconvulsive status epilepticus after subarachnoid hemorrhage[J]. Neurosurgery, 2002, 51(5): 1136-1143;
[111] Little AS, Kerrigan JF, Mcdougall CG, et al. Nonconvulsive status epilepticus in patients suffering spontaneous subarachnoid hemorrhage[J]. J Neurosurg, 2007, 106(5): 805- 811.
[112] Rhoney DH, Tipps LB, Murry KR, et al. Anticonvulsant prophylaxis and timing of seizures after aneurysmal subarachnoid hemorrhage[J]. Neurology, 2000, 55(2): 258-265.
[113] Raper DM, Starke RM, Komotar RJ, et al. Seizures after aneurysmal subarachnoid hemorrhage: a systematic review of outcomes[J]. World Neurosurg, 2013, 79(5-6): 682-690.
[114] Hart Y, Sneade M, Birks J, et al. Epilepsy after subarachnoid hemorrhage: the frequency of seizures after clip occlusion or coil embolization of a ruptured cerebral aneurysm: results from the International Subarachnoid Aneurysm Trial[J]. J Neurosurg, 2011, 115(6): 1159-1168.
[115] Rosengart AJ, Huo JD, Tolentino J, et al. Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs[J]. J Neurosurg, 2007, 107(2): 253-260.
