凝血检验结果自动审核规则建立与验证的多中心研究
2020年8月
中华神经科杂志,第43卷第8期 第802页-第811页
曲林琳,吴俊,吴卫,王蓓丽,刘向祎,江虹,黄珣钡,杨大干,李永哲,杜彦丹,郭玮,孙德华,王玉明,马伟,朱明清,王贤,隋洪,寿玮龄,李强,迟林,李爽,刘晓璐,王卓,曹君,包春喜,夏永泉,曹辉,安倍莹,郭芙瑜,冯厚梅,闫岩,黄光日,续薇
随着实验室自动化的不断发展,检验后结果的自动审核也逐渐受到国内外实验室的关注。对于凝血检验结果自动审核的探索,近年来国内外已有一些文献报道将凝血常用报告参数凝血酶时间(thrombin time, TT)、凝血酶原时间(prothrombin time, PT)、国际标准化比值(international normailized ratio, INR)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen, FBG)、D-二聚体(D-dimer DD)、血浆纤维蛋白(原)降解产物(fibrin/fibrinogen degradation products, FDP)设置为自动审核条件[1,2,3,4],一定程度上减轻了人工复检的工作量,缩短了实验室内报告周转时间(turn-around time, TAT)。但如何建立凝血检验的自动审核,凝血检验自动审核规则应用哪些参数,如何将参数合理组合优化以有效拦截异常结果,如何利用自动化仪器识别标本性状异常,如何解决标本量异常及其他可能影响结果的干扰,这些困惑依然影响着凝血检验自动审核的进程。为此,2019年9月,中华医学会检验医学分会临床血液体液学组正式分组启动了凝血检验结果自动审核规则建立与验证的多中心研究,目的是建立能够满足日常凝血检验和报告需求的自动审核规则,为凝血检验结果自动审核提供思路和方法。多中心成员单位依据美国临床和实验室标准化研究所的《临床实验室检验结果的自动审核标准:指南(AUTO-10A)》[5]和《医学实验室各专业检验结果自动审核(AUTO-15)》[6],开展了凝血自动审核规则的设计、建立、实施及验证等工作。
收集2019年12月至2020年3月吉林大学第一医院检验科、北京协和医院检验科、北京积水潭医院、浙江大学附属第一医院检验科、南方医科大学南方医院检验科、内蒙古林业总医院检验科、苏州大学附属第一医院检验科、苏州市立医院检验科、北京同仁医院检验科、复旦大学附属中山医院检验科、四川大学华西医院检验科、昆明医科大学第二附属医院检验科、南京鼓楼医院检验科、东莞康华医院检验科的枸橼酸钠抗凝标本(血液与水合枸橼酸钠抗凝剂比例为9∶1)共91 663份,来源于门诊或住院不同科室(如血液科、心血管科、骨科、ICU、肾病科、呼吸科、妇科等)。其中,自动审核规则建立组11 230份,含差值检验(Delta check)的凝血标本1 182份,结果异常标本不低于20%(
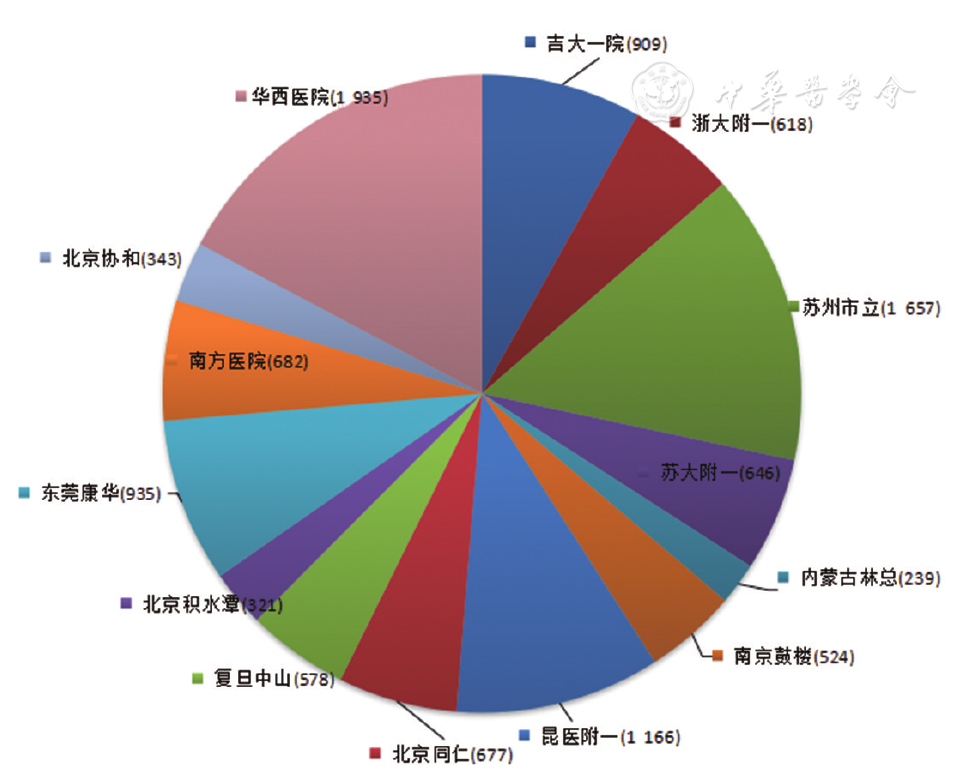
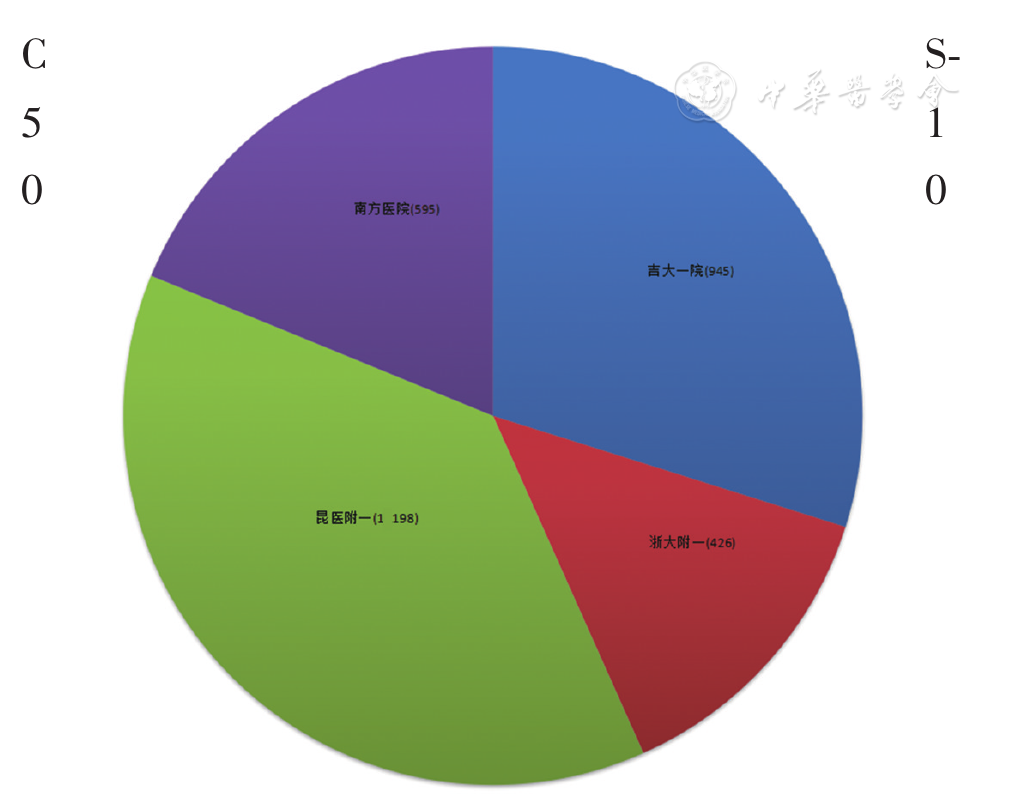
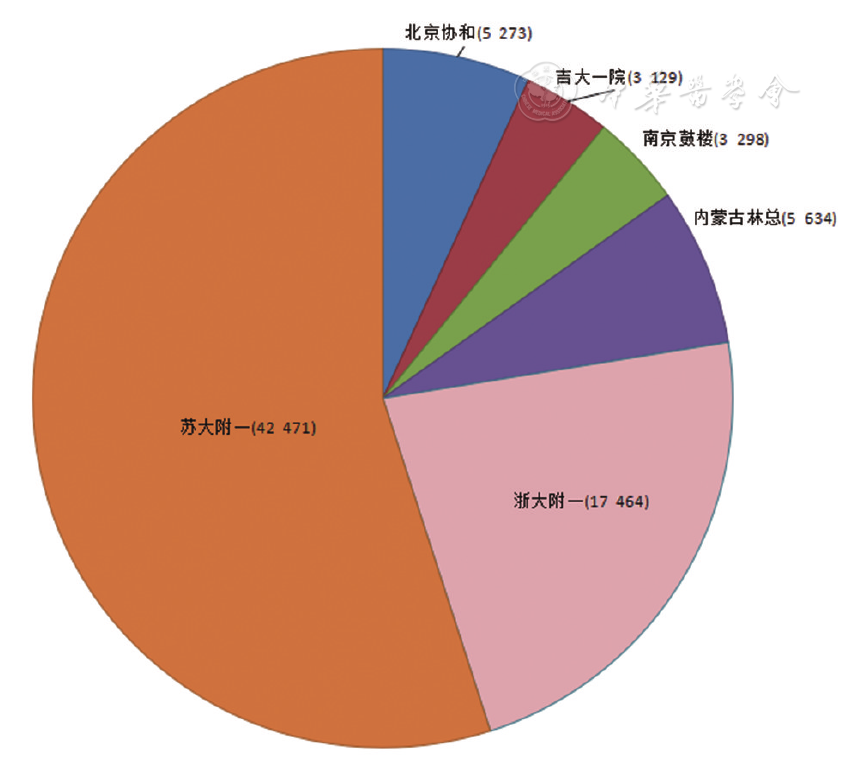
多中心研究成员单位建立凝血检验结果的自动审核规则,采取依不同检测系统分组的方式进行,本研究的检测系统为Sysmex CS-5100系列仪器全自动血凝分析仪、配套检测试剂、校准品、质控品(上海希森美康公司)。
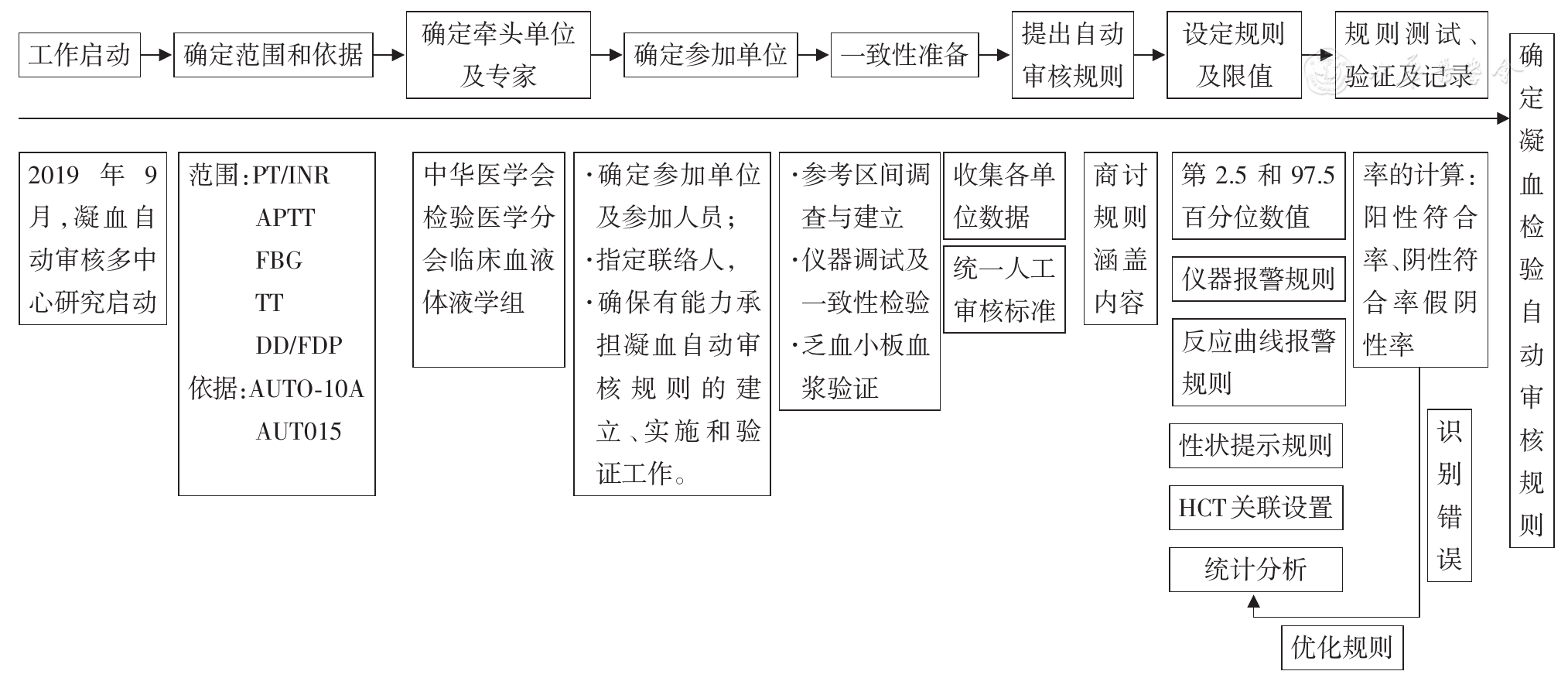
1.研究依据:依据AUTO-10A和AUTO-15第三章3.2凝血部分中关于自动审核规则的设计、建立、实施、验证的建议,设计了本研究的思路和技术路线(
2.仪器准备:所有参与单位使用的水平离心机检定合格,并且验证在1 500×g离心15 min后得到乏血小板血浆即血浆中PLT<10×109/L。所有参与检测的血凝分析仪均通过校准及性能验证,每日室内质控及室间质评成绩合格;校准溶血、黄疸、脂血(hemolytic, icterous or lipemic, HIL)位置同时在仪器处理模块系统设置HIL标本性状提示及PT/FBG演算结果。
3.项目定标:FBG、DD、FDP等项目常规至少每月定标,遇试剂批号更换时重新定标。
4.参考区间:参考区间的建立与验证用于各实验室间评价标准的统一。
参考区间建立:多中心研究各项目的参考区间根据CLSI 《医学实验室参考区间的定义、建立和验证:推荐指南》第三版(C28-A3)建立[7]。从各成员单位检验科收集表观健康成年(18~65岁)男女共1 007名,健康个体的要求:(1)自觉健康;(2)无血液系统疾病(贫血、白血病、血小板异常疾病等)、变态反应性疾病(荨麻疹等)、呼吸系统疾病、泌尿系统疾病、消化系统疾病、风湿性疾病、甲状腺疾病、寄生虫感染、恶性肿瘤和遗传性疾病、高血压[收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg];(3)近期未曾手术或服用药物;(4)近期未曾献血、输血或大量失血;(5)无消瘦,营养不良;(6)无酗酒;(7)近期无剧烈运动或重体力劳动;(8)无慢性理化损伤;(9)女性无月经过多,未处于妊娠或哺乳期。血常规、尿常规、便常规及便潜血、肝功能相关指标丙氨酸氨基转移酶、胆红素正常,肾功能相关指标尿素、肌酐、尿酸正常,血脂相关指标三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇正常,体格检查、胸片、心电图、腹部B超无明显异常。排除妊娠、哺乳。数据以95%可信区间确定参考区间(
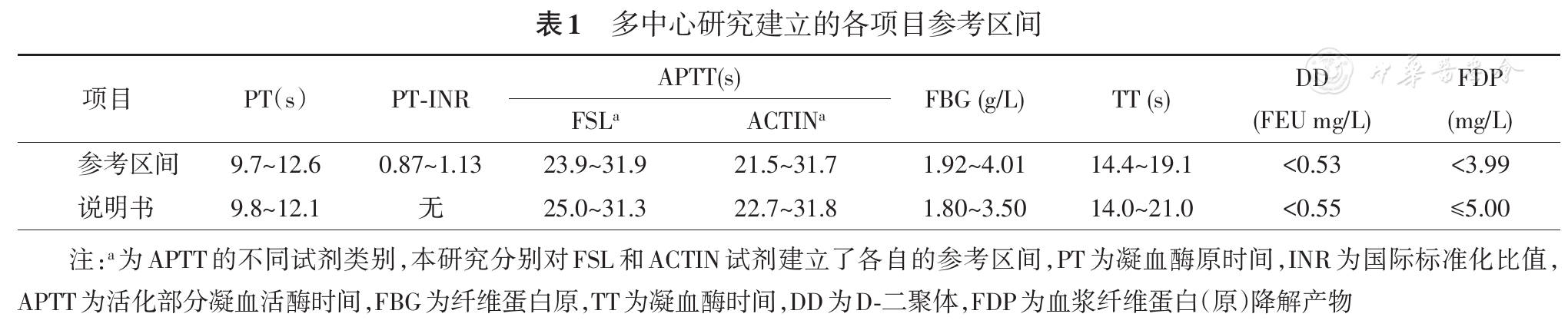
参考区间验证:每家单位收集覆盖各年龄段且男女比例1∶1的表观健康人凝血标本20份用于验证所建立的参考区间,90%以上数据处于参考区间内判定为验证通过。
5.标本检测:参照《血浆凝固实验血液标本的采集及处理指南》(WS/T 359-2011),枸橼酸钠抗凝血标本在室温、1 500×g离心15 min后,得到乏血小板血浆,并要在采血后1 h内离心分离血浆,4 h内完成检测,检测项目涵盖凝血项目PT、INR、APTT、FBG、TT、DD、FDP,检测操作按照统一的标准操作规程完成。
6.数据采集:关于自动审核规则建立前需要考虑的要素,收集:(1)标本信息,包含日期、性别、科室、年龄、诊断、接收/检测/审核时间、临床诊断及抗凝药用药史等;(2)报告参数,PT、INR、APTT、FBG、TT、DD、FDP的检测结果及PT/FBG演算结果;(3)仪器报警信息,如HIL标本性状提示、反应曲线报警;(4)LIS备注信息,如溶血、脂血、黄疸等标本状态的记录;(5)其他相关检测,如凝血因子(Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅺ、Ⅻ)、蛋白C、蛋白S、狼疮抗凝物、红细胞比容、总胆红素、直接胆红素、总甘油三酯结果数据。将所有标本相关数据合并汇总用于统计学分析。
7.人工审核:进行凝血结果人工审核标准的调查,结合行业标准和共识制定统一的人工审核标准,征得临床医生同意,且无差错报告,证明人工审核的准确性和适用性,并进行培训。由各参与单位经过培训的凝血检验人员对自动审核规则建立和验证的标本结果进行人工审核,在每个结果后标注通过、待性状复检、待仪器复检(重测、稀释重测)、结合其他检查等。
8.自动审核规则拦截条件及限值:将所有标本相关数据和人工审核结果汇总后进行统计学分析。在回顾2019年全年凝血检测数据基础上,对自动审核规则建立组PT、APTT、FBG、TT的数据从小到大排序,累计的百分位中取第2.5和第97.5百分位数,对应的数值分别设为PT、APTT、FBG、TT自动审核的限值,并结合临床意见、危急值及相关指南进行调整,初步确定对PT、APTT、FBG、TT数值异常的自动审核拦截限值,此外还配合反应曲线、线性、性状提示等报警信息予以拦截;DD和FDP审核条件采用逻辑判断、线性和反应曲线异常作为拦截条件。
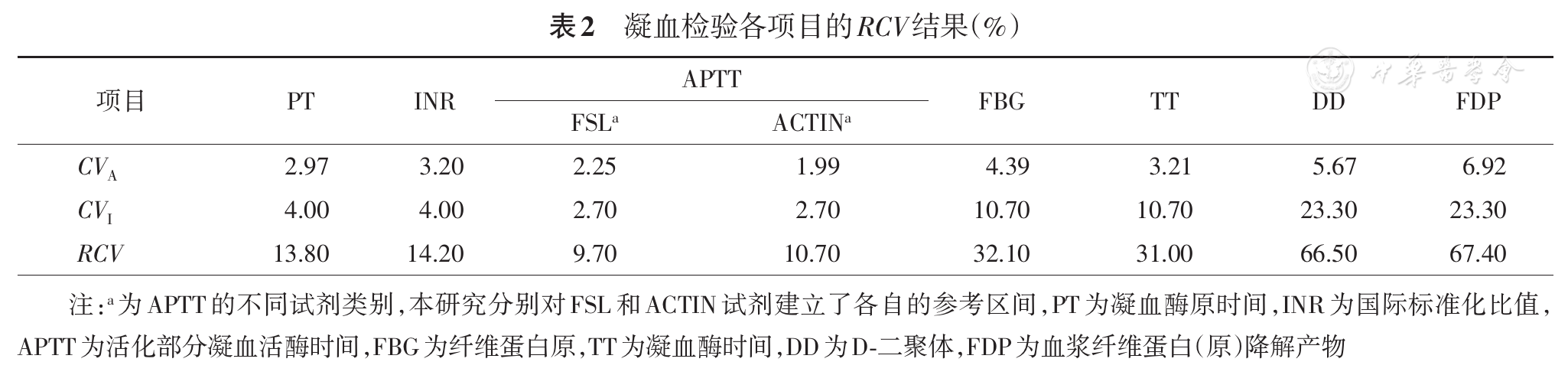
9.Delta check限值:采用参考变异系数(reference change value,RCV)方法确定。RCV的计算公式为RCV=21/2 × Z ×(CVA2+CVI2)1/2,其中CVA为分析中变异,每个项目CVA即所有单位累积平均CV;CVI为相应项目的生物学变异,从Westergard网站获取(https://www.westgard.com/biodatabase1.html);Z是标准正态分布的临界值,取值为1.96,对应的RCV为95%RCV,作为每个检验项目的总变异(
10.统计学分析:利用SPSS 21.0统计学软件,采用百分位数法拟定PT、APTT、FBG、TT自动审核规则的上限和下限;采用配对卡方和KAPPA检验分析自动审核规则一致性和相关率的差异;采用Mann-Whitney U秩和检验统计自动审核规则应用前后TAT时间变化差异。
11.率的计算:计算自动审核规则与人工审核的阳性符合率、阴性符合率、假阴性、假阳性、自动审核通过率和通过正确率,计算公式为:
假阴性率(无效审核)=未触发审核规则标本中假阴性份数/标本总份数×100%
阳性符合率=阳性符合标本数/标本总份数×100%
阴性符合率=阴性符合标本数/标本总份数×100%
一致率=阳性符合率+阴性符合率
假阳性率(无效拦截)=假阳性标本数/标本总份数×100%
通过率=未触发审核规则份数/标本总份数×100%
通过正确率=未触发审核规则标本中真阴性份数/通过标本总份数×100%
12.规则优化:通过率的计算,发现假阴性和错误报告;对华法林、肝素等特殊用药史、孕产妇特殊群体设置个性化条件,将其设置于自动审核软件中,根据该条件拦截的特异度和敏感度需求即漏诊的可接受程度,确定其界限值。
13.规则验证:将建立的自动审核规则设置在仪器软件中,与人工审核相比,验证自动审核规则的阳性符合率、阴性符合率、假阴性、假阳性、自动审核通过率和通过正确率,分析自动审核前后实验室内TAT(指从上机检测到报告审核的时间中位数)的变化情况,评价凝血检测结果自动审核规则的实施效果。
14.制定凝血检验结果自动审核流程图。
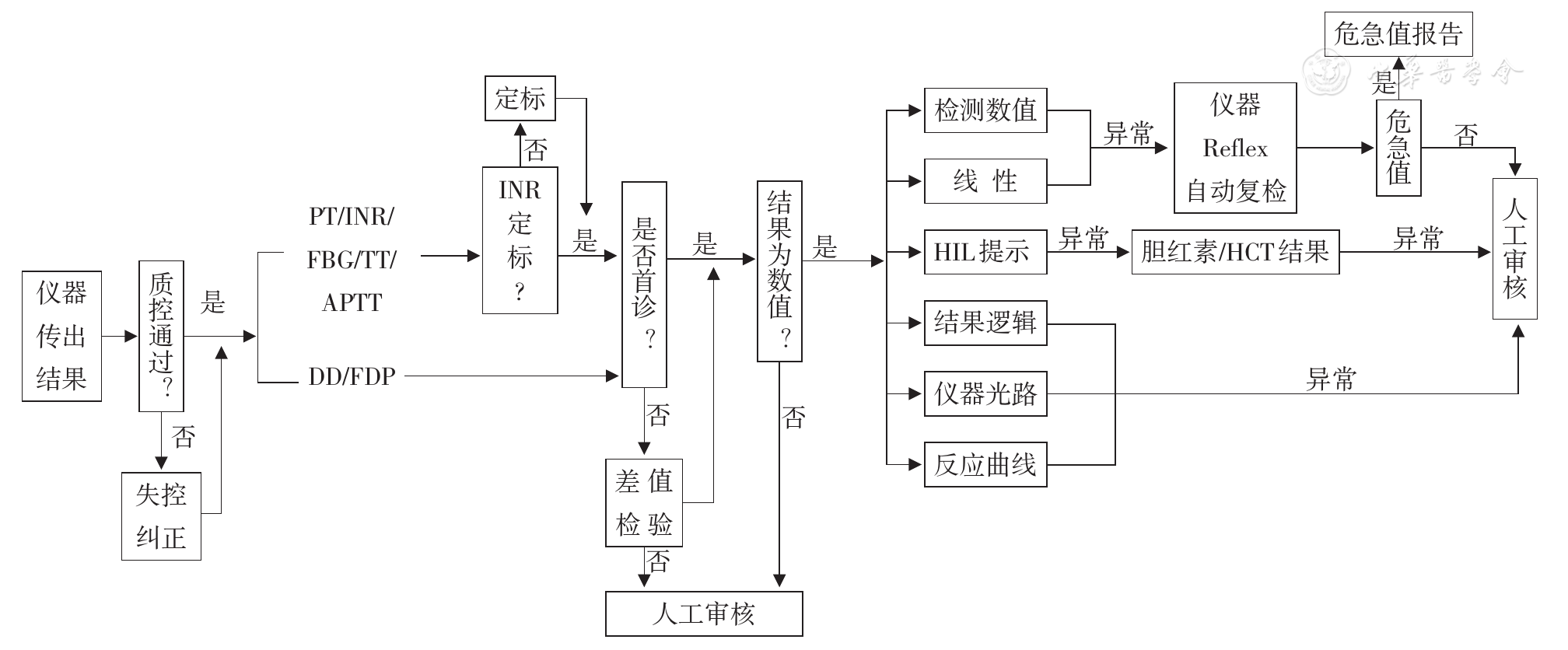
确定凝血检验结果自动审核流程:以AUTO-10A和AUTO15第三章3.2凝血部分的要求为基础,本研究综合室内质控、项目定标、差值检验、结果限制、仪器报警(如反应曲线、异常性状及超线性等)、危急值及复检动作,确定凝血检验结果自动审核的流程并绘制流程图。
审核规则类型:数值异常1~4条、线性异常5~11条、标本性状异常12~14条、逻辑不符15~16条、光路异常17~18条、反应曲线异常19~27条、Delta check规则28~33条,见

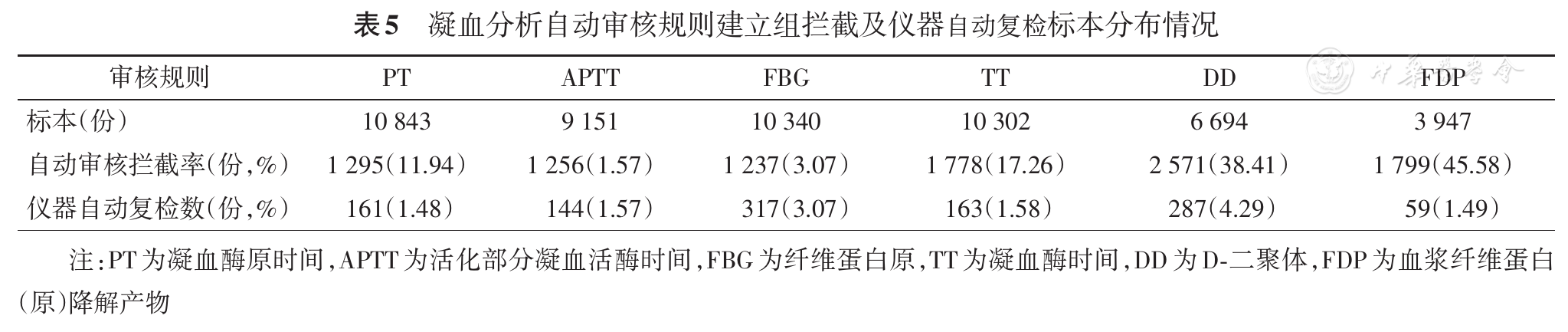
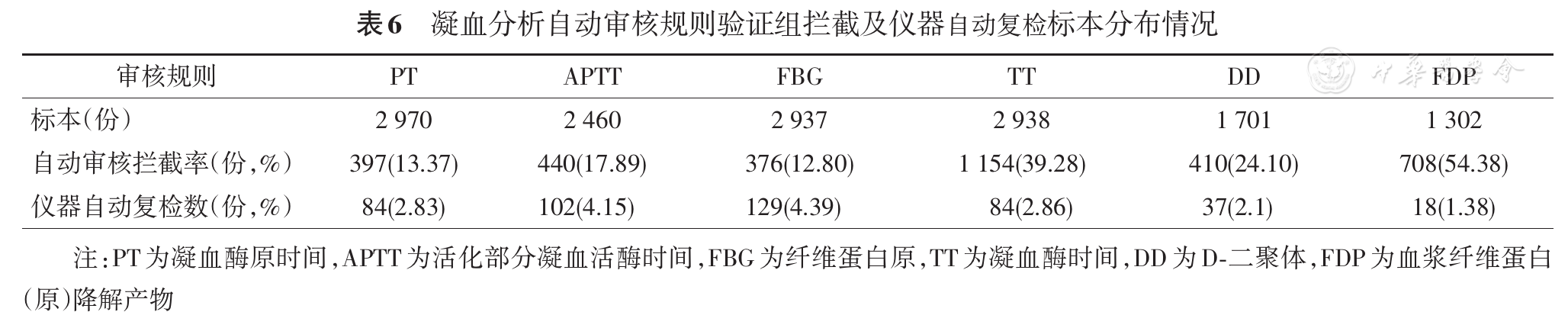
1.凝血检验自动审核规则建立和验证标本14 394份,其中自动通过标本份数分别为7 684份和1 910份,自动审核通过率、拦截率、人工和自动审核一致率、符合率、假阴性率见

2.凝血检验自动审核规则建立组和验证组自动审核拦截标本数分别为3 546份和1 254份,仪器自动复检标本数分别为620份和181份,具体分布见
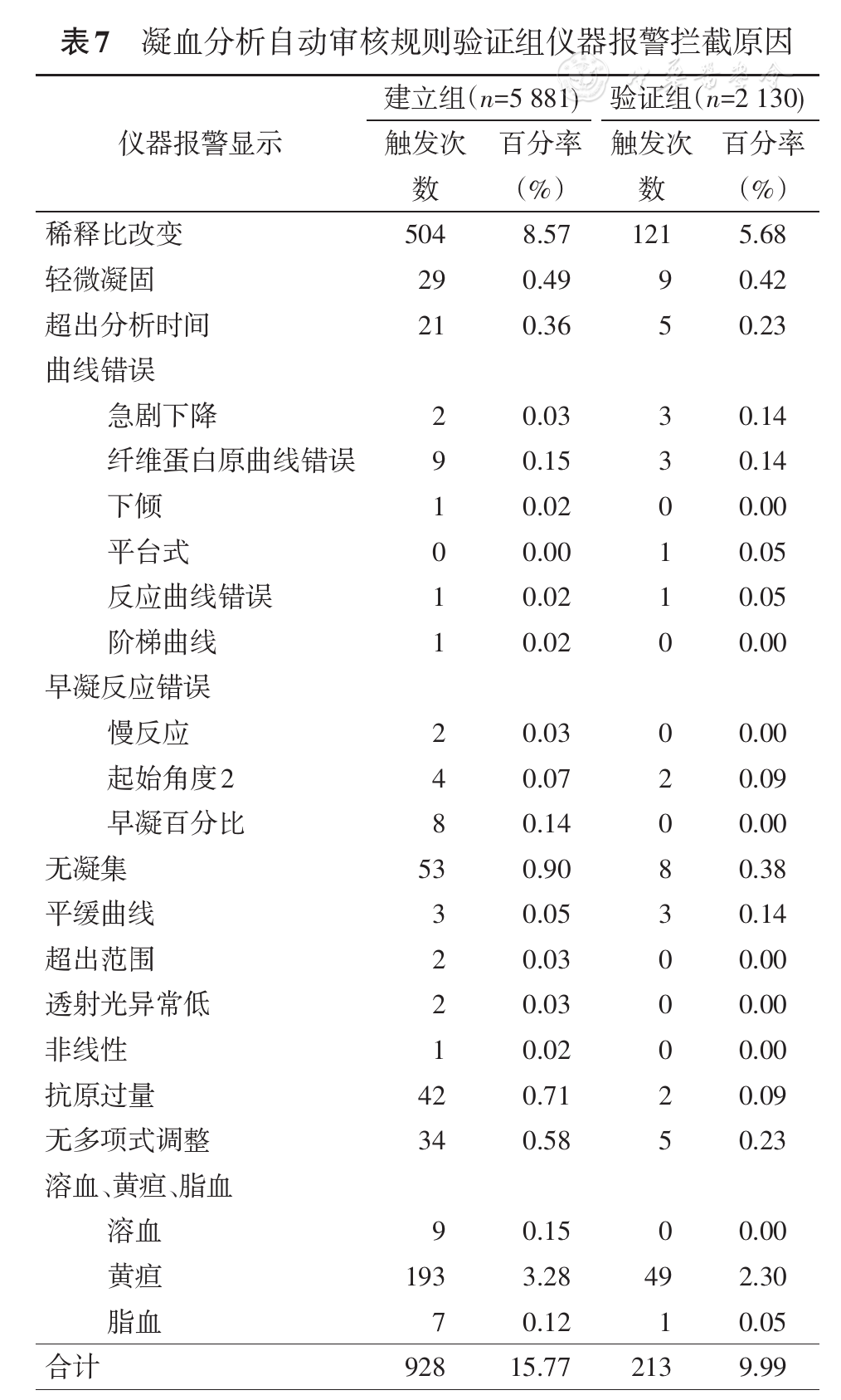
3.凝血检验自动审核规则建立组和验证组仪器报警拦截情况见
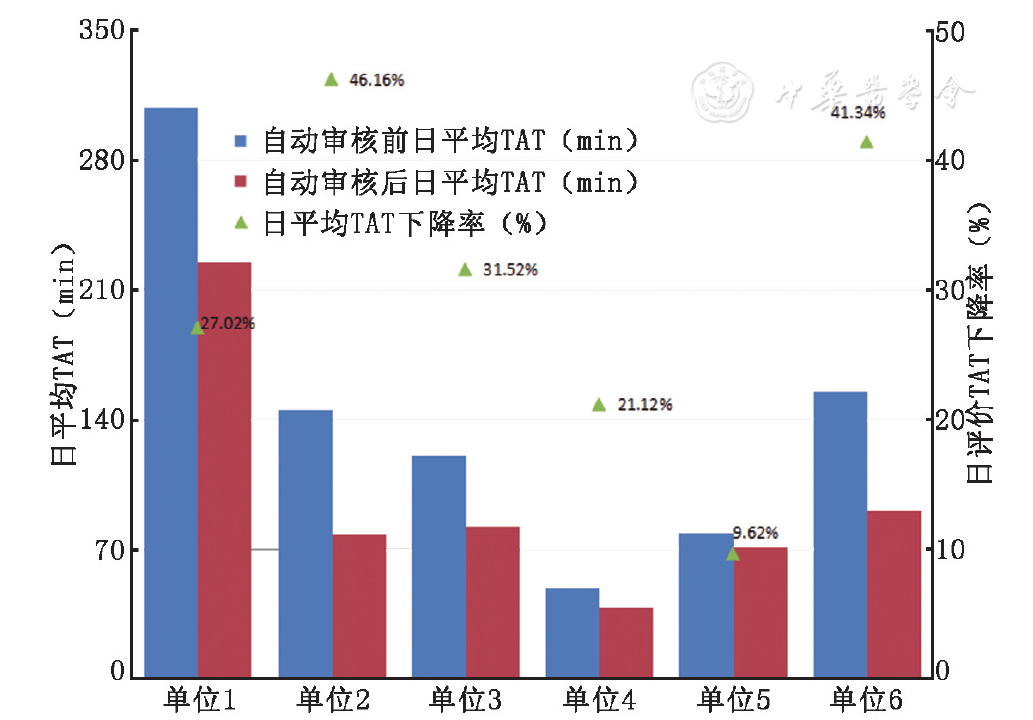
6家医院(苏州大学附属第一医院、浙江大学附属第一医院、内蒙古林业总医院、北京协和医院、吉林大学第一医院、南京鼓楼医院检验科自愿参与验证工作,共收集77 269份凝血检验自动审核试应用,自动审核应用前后实验室内平均TAT见
根据上述考虑,制定出凝血检查项目相应的自动审核流程图(
检验结果的自动审核是在仪器检测完成后,检测数据由计算机按照实验室预先设定的标准和逻辑规则判断检验结果是否通过审核并发送到临床,这一检验后过程的自动化,使检验从检验前、检验中、检验后全流程实现了自动化[3]。国外对于自动审核的探索和应用报道较早[8],且多数集中在常规生化和免疫类检测项目[9];近年来,国内一些大型三甲医院检验科开始尝试应用自动审核来优化检验后流程,提高生化检验审核效率[10]。实践证明,自动审核能够提高检验后结果报告效率。血常规和尿常规检验因涉及形态学相关参数,自动审核规则制定较为复杂,中华医学会检验分会血液体液学组于2017年启动血液分析自动审核规则建立与验证的多中心研究工作,依照AUTO 10A建立血液分析自动审核规则15项43条[11],经验证和临床试应用,不仅将仪器参数与形态学相关联设入自动审核规则,还在保证检验质量的同时缩短TAT,提高了检验工作效率,经过周期性验证和优化调整,如今已成为血常规报告审核不可缺少的工具。
血液检验领域除血常规外,凝血检验和血细胞形态学等项目结果自动审核在国内开展较少,与血液、生化不同,凝血检验更容易受检验前因素的干扰,如标本与抗凝剂比例、微小凝块、标本性状(溶血、黄疸、脂血)、抗凝药物、病理性抗凝物质等都可影响凝血结果的准确,据统计,检验前错误造成凝血报告不正确的比例达60%~70%[12]。中华医学会检验分会临床血液体液学组2019年9月召开启动会,确定了开展凝血检验不同检测系统的自动审核规则建立与验证的多中心研究,各参加单位检验科负责人、凝血检验专家和医生代表参会。按照AUTO15第三章凝血检验自动审核工作的思路,2019年9月至10月,确定检测系统分组、各小组参加单位及牵头单位;2019年11月,各参加单位完成参考区间数据收集、仪器调试及一致性检验、乏血小板血浆验证;2019年12月,完成参考区间数据收集、与参加单位商讨规划规则涵盖内容、标本信息及数据收集要求;2019年1月至3月,进行多中心数据收集、汇总,自动审核规则建立、验证、优化调整,最终确定本组凝血检验自动审核规则。
依据AUTO 10A和AUTO15的建议,本规则共设定拦截条件包括数值异常、线性异常、标本性状异常、光路异常、反应曲线异常、逻辑不符和Delta check规则7方面33条。
本研究将室内质控和INR定标设为自动审核运行的前提条件。按照中国合格评定国家认可委员会2018年发布的《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》(CNAS-CL 02-A001),标本检测当天至少1次进行至少2个浓度水平(正常和异常水平)的质量控制;遵循CLSI发布的H47 A2--《One-Stage Prothrombin Time (PT) Test and Activated Partial Thromboplastin Time (APTT) Test》[13],PT试剂批号变更时应重新建立正常PT均值(MNPT),并对INR进行定标。因此,当室内质控通过并且PT试剂在INR定标有效的批号内,则自动审核程序对允许限内的标本放行;当室内质控结果不可接受时,所有结果不予自动审核;当PT试剂批号更换而INR未定标,自动审核也不予审核。
(1)在回顾参与单位2019年全年凝血常规(PT、INR、APTT、TT、FBG)历史结果基础上,将自动审核规则建立组9 295份标本结果从低到高排序后,取P2.5和P97.5对应的值分别作为PT/INR、APTT、TT、FBG自动审核的允许限值(低限、高限),见
(1)INR、FBG、DD及FDP的线性拦截规则,AUTO-15 3.2.1及3.2.2.2建议,对于有检测上限的结果不应报告">?",因此多中心研究调研了各单位INR、FBG、DD及FDP的线性范围后,从中取最低值作为上述项目的线性拦截规则,拦截后通过自动稀释或浓缩重测,报告具体数值,才能通过审核;每个实验室在建立线性拦截条件时,也可回顾本单位多个历史批号从中取最低值作为线性拦截条件;对于与凝血异常明显相关的疾病如肝病、出血性疾病,通过设置PT、APTT、FBG结果异常的拦截,以实现与特殊疾病的关联。(2)综合INR在房颤、静脉血栓等疾病诊疗监测相关指南[14,15,16,17],INR监测目标值因不同疾病、不同病情而有所不同,监测周期也在2~7 d不等,故本研究INR结果在Delta check拦截条件中设置,经验证未出现漏诊。实验室在确定INR规则时应根据患者群体进行个性化设置并加以验证,以满足监测要求。(3)危急值审核规则:凡是属于危急值的检验结果,强调一律不予通过自动审核。危急值的认定因各参加单位差异较大,多中心研究未将其纳入自动审核规则,但是在此建议,在自动审核规则实施前,应参考国际血液学标准委员会对止凝血危急值、检测及报告的建议[18],并将其设入自动审核规则的拦截条件。
1.溶血、脂血、黄疸会影响基于光学法的检测,PT、INR、APTT、TT、FBG、DD及FDP检测结果准确性受到影响,这种情况下仪器会出现"HIL"即hemolytic(溶血)、ccterus(黄疸)、lipemic(乳糜)报警提示,将相应异常标本拦截。溶血、脂血、黄疸程度对凝血检验结果影响的研究认为[19],轻度时不会造成结果偏差,本研究通过仪器中对不同项目设置不同的HIL提示水平,如PT(H4/I1/L5)、APTT(H1/I1/L1)、FBG(H5/I1/L3)、DD(H5/I1)时报警提示以拦截性状异常标本。每种检测系统对溶血、脂血、黄疸的抗干扰性能不同,对凝血检测可进行干扰试验,以确定溶血、黄疸、脂血对凝血检验结果的干扰程度。
2.HCT>55%时,LIS对结果拦截,需核对抗凝剂与血浆的比例是否合适。
仪器报警信息涵盖线性异常(第8、10、11条)、标本性状异常(第12条)、光路异常(第17~18条)、反应曲线异常(第19~27条),自动审核规则建立与验证中,各种报警信息触发的标本份数和百分率见
多中心研究将差值检查时限为7 d[20],并为每个项目设置可接受范围。可接受范围的计算依据RCV[21],定义为患者2次检查结果变异的可接受范围在±95%参考CV之内。当患者的检验结果与历史结果的差异不在可接受范围内,但都在参考范围内,则自动审核通过;如果任意1次不在参考范围内,前后结果差异不在可接受范围内,系统给予拦截。
各个项目之间的逻辑关系,不符合逻辑关系的结果一律不得自动审核。多规则逻辑审核规则包括:(1)DD不得高于FDP;(2)PT演算法与FBG实测法(Clauss法)差值超过2倍,可协助筛查低纤维蛋白血症和遗传性异常纤维蛋白血原症的患者。
本次多中心研究策划、建立并验证了凝血检验结果自动审核33条规则,经临床试应用认为,整合数值判断、线性异常、逻辑判断、反应曲线、性状提示和Delta check的自动审核规则,能够帮助弥补人工审核由于经验性和主观性偏差造成的漏诊和误判。
[1] Onel?v L, Gustafsson E, Gr?nlund E, et al. Autoverification of routine coagulation assays in a multi-center laboratory[J]. Scand J Clin Lab Invest, 2016,76(6):500-502.
[2] Wang Z, Peng C, Kang H, et al. Design and evaluation of a LIS-based autoverification system for coagulation assays in a core clinical laboratory[J]. BMC Med Inform DecisMak, 2019,19(1):123.
[3] Mlinaric A, Milos M, Coen Herak D, et al.Autovalidation and automation of the postanalytical phase of routine hematology and coagulation analyses in a university hospital laboratory[J]. ClinChem Lab Med, 2018,56(3):454-462.
[4] Froom P, Saffuri-Elias E, Barak M. Autovalidation rates in an outpatient coagulation laboratory[J]. Int J Lab Hem, 2015,37(5):680-685.
[5]
[6]
[7]
[8] Pearlman ES, Bilello L, Stauffer J, et al. Implications of autoverification for the clinical laboratory[J].ClinLeadershManag Rev, 2002,16(4):237-239.
[9] 朱晶,潘柏申.临床检验结果自动审核应用进展[J].临床检验杂志,2018,36(12):886-890.
[10] 马丽,万海英.运用Data Manager 2中间件实现生化检验报告高效审核[J].临床检验杂志, 2011,29(7):487-489.
[11] 续薇,郝晓柯,崔巍,等.血液分析自动审核规则建立与验证的多中心研究[J].中华检验医学杂志,2018,41(8):601-607.
[12] Lippi G, Chance JJ, Church S, et al.Preanalytical quality improvement: from dream to reality[J]. ClinChem Lab Med, 2011,49(7):1113-1126.
[13]
[14] 张澍,杨艳敏,黄从新,等.中国心房颤动患者卒中预防规范(2017)[J].中华心律失常学杂志, 2018,22(1):17-30.
[15] 中华医学会心血管病学分会,中国老年学学会心脑血管病专业委员会.华法林抗凝治疗的中国专家共识[J].中华内科杂志, 2013,52(1):76-82.
[16] Hauk L. Management of Non-ST Elevation Acute Coronary Syndrome: A Guideline from the AHA and ACC[J]. Am Fam Physician, 2015,92(2):151-153.
[17] Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation[J].Eur Heart J, 2018,39(16):1330-1393.
[18] Robert C. Gosselin, Dorothy Adcock, et al. International Council for Standardization in Haematology Recommendations for Hemostasis Critical Values, Tests, and Reporting[J].Semin Thromb Hemost, 2019.
[19] 任婷玉,郑磊.止凝血检验分析前阶段影响因素研究进展及处理建议[J].血栓与止血学, 2014,4:204-207.
[20] Rheem I, Lee KN. The multi-item univariate delta check method: a new approach[J]. Stud Health Technol Inform, 1998;52
[21] Ko DH, Park HI, Hyun J, et al. Utility of Reference Change Values for Delta Check Limits[J]. Am J ClinPathol, 2017,148(4):323-329.
