血管性血友病因子GPIb活性/抗原比值在血栓性血小板减少性紫癜快速鉴别诊断中的价值
2020年8月
中华神经科杂志,第43卷第8期 第812页-第815页
唐宁,赵倩雯,白欢,李登举
血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP)是一种罕见但可危及生命的血栓性微血管病,临床上多见血小板减少、微血管病性溶血和意识障碍三联征。及时诊断对于降低TTP病死率至关重要[1]。TTP的实验室特征可表现为外周血血小板减少、裂片红细胞增多、肾功能异常等,但这些特征可见于多种临床状况,特异度较低。此外,裂片红细胞在TTP早期也可能缺少[2]。而对TTP有诊断价值的血管性血友病因子(von Willebrand factor vWF)裂解酶——ADAMTS13活性测定,大部分临床实验室尚无条件开展。尽管近年来基于实验室特征和病史的临床评分如PLASMIC评分被证实对TTP有较高的预测价值[3],但基于我们既往的研究[4],其特异度仍较低。
既往研究已证实TTP患者急性期往往存在大分子vWF多聚体的缺乏,这可能归因于大分子vWF被微血栓占用,导致血浆中游离的vWF中大分子多聚体减少[5]。由于vWF的活性水平主要由大分子vWF多聚体决定,vWF活性与抗原之比可评估vWF是否存在质量缺陷。因此我们推测vWF:GPIb活性/vWF抗原比值也可能有助于急性期TTP的快速鉴别。本研究旨在验证该比值对于TTP的诊断效率,以及在疑诊TTP的各类临床疾病中的鉴别价值。
筛选2018年1月至2019年12月入住同济医院疑诊TTP的患者,纳入其中符合以下标准的患者作为观察对象:血小板显著减低(<50×109/L)且伴有溶血表现(存在以下至少一项:外周血裂红细胞>2%,网织红细胞>2.5%,间接胆红素>20.0 mg/L,结合珠蛋白低于检测下限,游离血红蛋白阳性)。血小板界值选择依据我们以往的观察性研究[4]。本研究经伦理委员会批准(TJ-IRB20191010),研究对象或直系亲属均签署知情同意书。
采集患者急性期枸橼酸钠抗凝全血,2 000×g离心10 min,用于检测vWF活性、抗原及ADAMTS13活性。vWF抗原和活性采用ACL TOP全自动血凝仪及其配套试剂(美国Instrumentation Laboratory公司)完成检测,均为免疫比浊法。其中vWF活性测定使用针对血小板结合位点(糖蛋白Ib受体)的特异性抗vWF单克隆抗体,与患者血浆中vWF反应,因此本研究对该活性测定方法采用特指名称vWF:GPIb活性。vWF抗原与vWF:GPIb活性的参考区间均为50%~200%。ADAMTS13活性及抑制物测定采用荧光共振能力转移技术,检测设备为Mithras LB 940荧光分析仪(德国Berthold Technologies公司),试剂为基于vWF86片段的商品化ADAMTS13活性测定试剂(美国Actifluor公司)。
TTP诊断定义为:(1)ADAMTS13活性<10%;(2)ADAMTS13活性<20%,同时抑制物测定阳性或ADAMTS13基因检出致病突变[1]。溶血尿毒综合征(haemolytic uraemic syndrome,HUS)诊断定义:存在血小板减少、溶血性贫血、急性肾功能障碍,且排除了TTP及其他原因所致急性肾病[6]。PLASMIC评分标准见
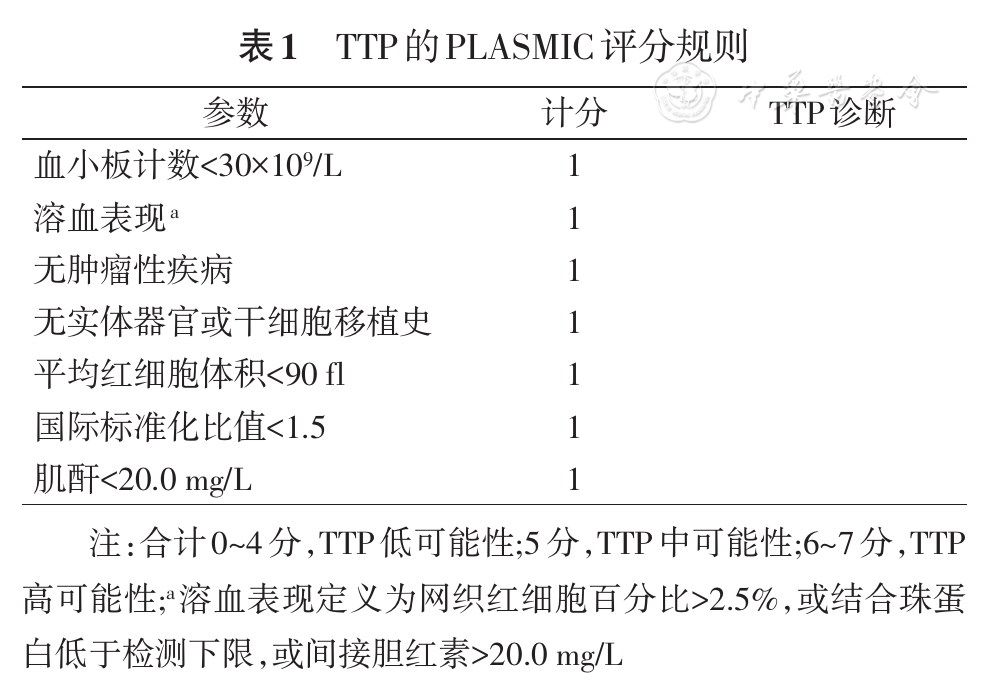
数据分析采用SPSS 21.0软件分析。连续变量的比较采用Mann-Whitney U检验,结果表示为M(Q1,Q3),分类变量的比较采用卡方检验。受试者工作特征曲线(ROC)用于评估TTP诊断阈值及相应敏感度、特异度。P<0.05为差异有统计学意义。
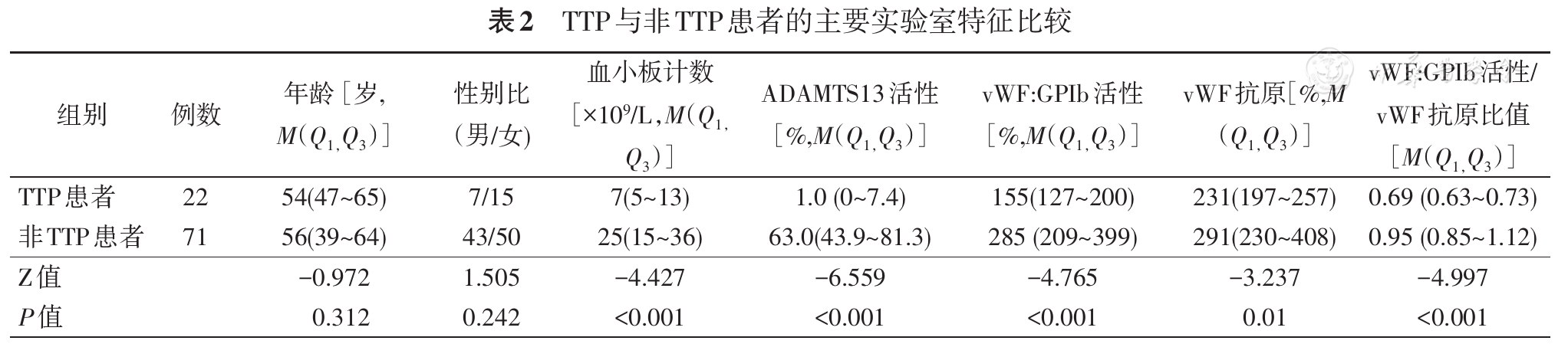
总计纳入符合观察标准的93例疑似TTP患者,其中22例(23.7%)符合TTP确诊标准,71例不符合TTP确诊标准,这些病例的最终诊断主要包括HUS 8例(8.6%),重症感染21例(22.6%),恶性肿瘤13例(14.0%),结缔组织病8例(8.6%),其余还有子痫/子痫前期3例,器官移植3例,巨幼细胞性贫血2例,骨髓异常增生综合征2例,肝硬化2例,肾功能衰竭2例,创伤2例,免疫性血小板减少症2例,胰腺炎1例,肝素诱导血小板减少症1例及未明确病因1例。TTP与非TTP两组患者的主要实验室特征对比见
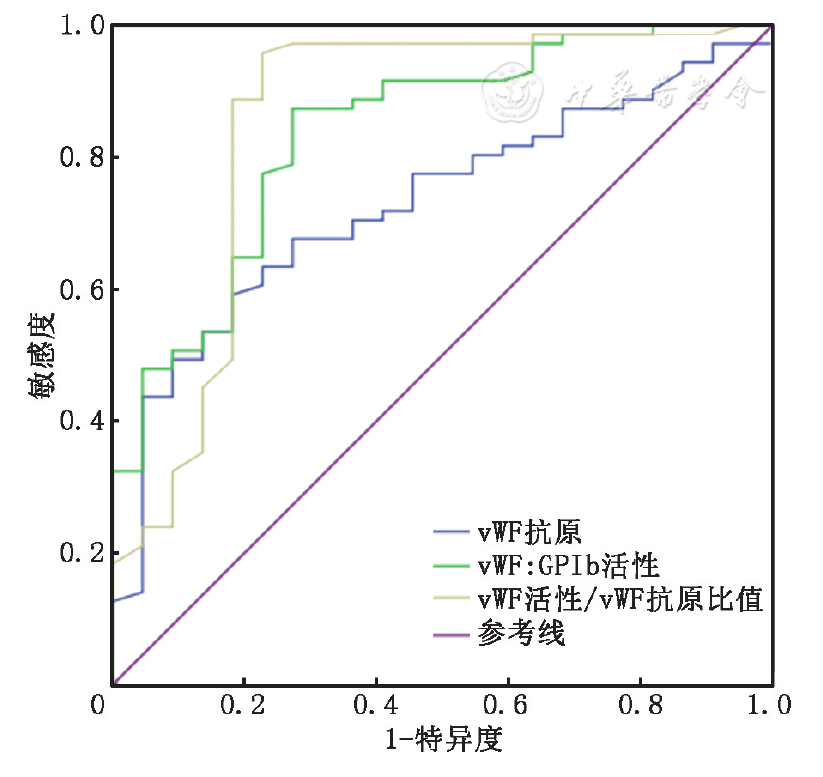
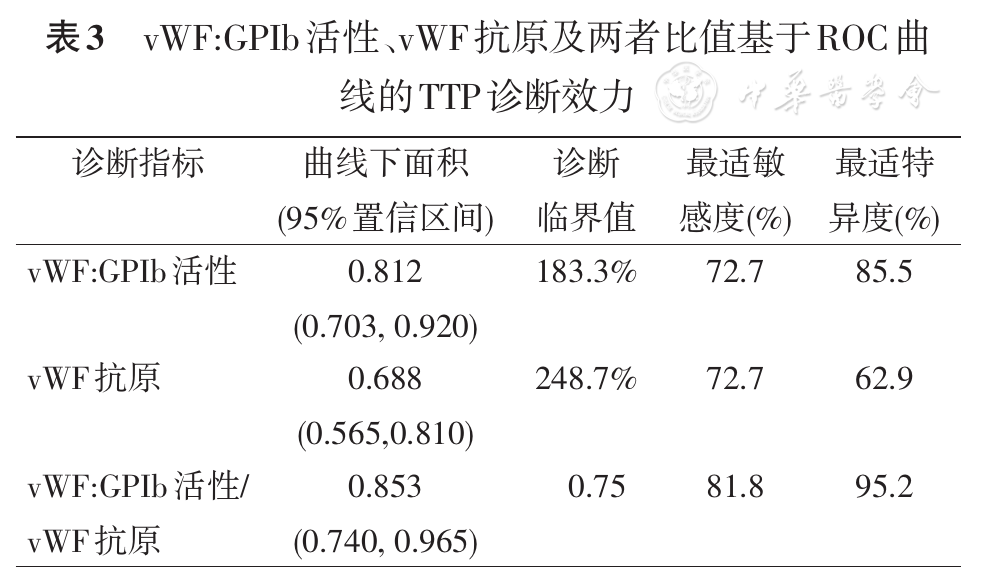
根据93例入组患者的ROC曲线(
重症感染的vWF:GPIb活性为355%(274%~423%),显著高于TTP(Z=-4.641, P<0.001)和HUS(Z=-1.978, P=0.045);恶性肿瘤的vWF:GPIb活性为382%(326%~476%),也显著高于TTP (Z=-4.268, P<0.001)和HUS(Z=-1.905, P=0.047)。
各病种vWF:GPIb活性/vWF抗原比值对比可以发现,TTP患者比值最低,与非TTP患者间差异显著(Z=-4.997, P<0.05);其次为HUS患者,比值也显著低于其他非TTP患者(Z=-1.932, P=0.046)(

注:箱体中的横线及箱体上下边反映该组数据的中位数及四分位间距,直线的上下缘反映该组数据的最大和最小值;α与TTP患者相比,P<0.05;β与HUS患者相比,P<0.05
有44例患者(47.3%)被PLASMIC评分判断为TTP高可能性,其中20例确诊TTP,该评分判断TTP的敏感度为90.9%,特异度为66.2%。44例患者利用vWF:GPIb活性/抗原比值进一步风险分层,vWF:GPIb活性/抗原比值<0.75者有88.9%最终确诊为TTP,比值≥0.75者有15.4%最终确诊为TTP。
TTP作为一种临床急危重症,若不积极治疗,死亡率可达90%。目前已知其病理机制为:遗传或获得性vWF裂解酶ADAMTS13缺乏,导致超大分子vWF不能正常被裂解,在高剪切力环境下与血小板结合形成微血栓,造成微血管病性溶血性贫血,微血管栓塞导致器官缺血缺氧,严重者发生功能衰竭[7]。因此在TTP急性期,vWF中的大分子多聚体多存在于微血栓中,导致循环中大分子vWF减少,这已在既往基于电泳和ELISA的分析中被证实[5,8]。
由于TTP患者普遍存在血管内皮损伤和血小板激活,导致vWF释放增多,本研究中86.4%(19例)的TTP患者vWF:GPIb活性超过100%,提示仅根据vWF活性不能有效反映大分子vWF的消耗状况。我们的研究采用vWF:GPIb活性/vWF抗原比值,可抵消掉vWF释放增多的干扰,更有助于反映大分子vWF的相对减少。vWF:GPIb活性在疑诊TTP人群的ROC曲线中体现出较高的诊断效力,但vWF:GPIb活性的最适界值(183.3%)在参考区间(50%~200%)之内,不适合用于TTP与一般人群的鉴别。
本研究中,除TTP外,HUS也有相较于重症感染、恶性肿瘤及其他诊断更低的vWF:GPIb活性/抗原比值,提示HUS也可能有与TTP相似的大分子vWF消耗,即存在高剪切力环境(微小动脉)下vWF介导的血小板黏附。而在临床上,部分HUS患者应用血浆置换治疗也效果良好[9],可能提示各类vWF:GPIb活性/抗原比值降低的临床状况都能从血浆置换中获益。而肿瘤、重症感染有较高的vWF:GPIb活性、抗原水平,但比值并无显著减低,表明尽管两者有最为显著的血管内皮损伤和血小板激活,但并不集中于高剪切力的微小动脉,而可能广泛存在于较大的动静脉血管[10]。
以vWF:GPIb活性/抗原比值<0.75为TTP诊断的判断阈值获得的特异度较高,但敏感度较低,不适合用于TTP的初筛。而我们的研究证实了临床评分工具PLASMIC评分对于TTP有较高的预测敏感度,但特异度较低,若仅按此评分。因此将vWF:GPIb活性/vWF抗原比值与PLASMIC评分相结合,可能有助于患者的风险分层、针对性处理,节省血浆资源:如评分高可能性且比值<0.75,需立即给予血浆置换;若仅评分高,则可考虑暂给予血浆输注等支持治疗,积极查找病因,同步送检ADAMTS13活性,以明确或排除TTP的诊断。
本研究的局限性在于样本量较小,且为单中心研究,结论若有多中心研究进一步确认将更为可靠。总之,鉴于延迟治疗可能显著增加TTP病死率,而获取vWF:GPIb活性和抗原测定结果简便迅速,因此对于不能及时检测ADAMTS13活性的医疗机构,利用vWF:GPIb活性vWF/抗原比值结合临床评分,或有助于疑诊TTP患者的快速判断及分层处理。
[1] Saha M, McDaniel JK, Zheng XL. Thrombotic thrombocytopenic purpura: pathogenesis, diagnosis and potential novel therapeutics [J]. J ThrombHaemost, 2017, 15(10):1889-1900.
[2] Moake JL. Thrombotic thrombocytopenic purpura: the systemic clumping "plague" [J]. Annu Rev Med, 2002, 53(1):75-88.
[3] Li A, Khalighi PR, Wu Q, et al. External validation of the PLASMIC score: a clinical prediction tool for thrombotic thrombocytopenic purpura diagnosis and treatment [J]. J Thromb Haemost, 2018, 16(1):164-169.
[4] Tang N, Wang X, Li D, et al. Validation of the PLASMIC score, a clinical prediction tool for thrombotic thrombocytopenic purpura diagnosis, in Chinese patients [J]. Thromb Res,2018, 172(1):9-13.
[5] Béranger N, Benghezal S, Savigny S, et al. Loss of von Willebrand factor high-molecular-weight multimers at acute phase is associated with detectable anti-ADAMTS13 IgG and neurological symptoms in acquired thrombotic thrombocytopenic purpura [J]. Thromb Res, 2019, 181(1):29-35.
[6] Noris M, Remuzzi G. Hemolytic uremic syndrome [J]. J Am SocNephrol, 2005,16(4):1035-1050.
[7] Dong JF, Moake JL, Nolasco L, et al. ADAMTS-13 rapidly cleaves newly secreted ultralarge von Willebrand factor multimers on the endothelial surface under flowing conditions [J]. Blood, 2002,100(12):4033-4039.
[8] Budde U, Schneppenheim R. Interactions of von Willebrand factor and ADAMTS13 in von Willebrand disease and thrombotic thrombocytopenic purpura [J]. Hamostaseologie. 2014, 34(3):215-225.
[9] Azoulay E, Bauer PR, Mariotte E, et al. Expert statement on the ICU management of patients with thrombotic thrombocytopenic purpura [published correction appears in Intensive Care Med [J]. Intensive Care Med, 2019, 45(11):1518-1539.
[10] Shahidi M. Thrombosis and von Willebrand Factor [J]. AdvExp Med Biol, 2017,906:285-306.
