发色底物法检测凝血因子Ⅷ活性的临床应用评价
2020年8月
中华神经科杂志,第43卷第8期 第816页-第822页
刘禹,许冠群,王学锋,戴菁
血友病是一种X染色体连锁的隐性遗传性出血性疾病,可分为血友病A(hemophilia A, HA)和血友病B两种。HA为凝血因子Ⅷ(FⅧ)缺乏,占所有血友病患者中约80%~85%,而HB为凝血因子Ⅸ(FⅨ)缺乏,占所有血友病患者中约15%~20%。由于其遗传特性,血友病多见于男性。血友病A在男性人群中发病率约为1/5 000[1]。
据Srivastava等[2]报道,约2/3的血友病A患者存在家族出血史且出血程度与凝血因子活性水平相关:(1)重型:凝血因子活性<1%,患者常出现自发性出血;(2)中间型:凝血因子活性在1%~5%,患者偶见自发性出血,在小型创伤性手术或外伤后会出现出血时间延长;(3)轻型:凝血因子活性在5%~40%,患者几乎不会发生自发性出血,但在大型创伤性手术或外伤后会有严重的出血。较为常见的出血事件主要有关节出血(如踝关节、膝关节、肘关节、肩关节、腕关节、髋关节等,约占70%~80%)和肌肉出血(约占10%~20%)。
长期以来,凝血因子替代疗法一直是最常见的预防和治疗血友病A的有效方法之一。其主要是通过使用重组凝血因子Ⅷ或血源性FⅧ浓缩制剂来达到治疗效果。治疗期间,可通过检测凝血因子Ⅷ活性(FⅧ∶C)来评估患者出血风险及治疗效果。而凝血因子Ⅷ抑制物的产生将大大影响血友病A患者接受替代疗法的效果,并随之带来巨大的出血风险与后续治疗难度[3,4]。
随着科技发展,非因子类药物治疗血友病A日益受到关注。双特异性单克隆抗体Emicizumab(亦称ACE910)便是其中之一。它是一种人源性的针对FⅨa和FⅩa的嵌合双特异性抗体,通过(部分)模拟FⅧ的功能而发挥止血作用[5,6,7]。使用目前国内常规开展的一期凝固法检测FⅧ∶C结果无法真实地评估接受此类药物治疗患者体内FⅧ∶C水平,也无法评估接受此类药物治疗的伴FⅧ抑制物的HA患者体内FⅧ抑制物滴度,因此需引入FⅧ∶C检测(发色底物法)对其作出客观评价。发色底物法的原理是基于检测因子Ⅷ作为辅因子与Ⅸa形成复合物活化因子Ⅹ的能力,通过检测生成的Ⅹa的量可计算因子Ⅷ的活性。该实验分为两步进行,第一步:待测标本与含有磷脂、钙离子、Ⅸa以及因子Ⅹ的试剂溶液进行孵育后生成Ⅹa;第二步加入发色底物进行检测,Ⅹa可作用在发色底物S2765,使其释放对硝基苯胺(paranitroaniline,pNA),后者可在405 nm波长条件下通过读取吸光度值计算该物质的生成量,进一步通过计算转换为FⅧ∶C[8]。因该检测方法在国内各实验室尚未开展,目前国内尚未有FⅧ∶C检测(发色底物法)临床应用评价的相关文献报道。本研究拟针对FⅧ∶C检测(发色底物法)进行检测性能验证(包括准确度、不精密度、检测下限、线性范围、携带污染率、参考范围、可报告范围等指标),同时将该方法与常规的一期凝固法进行比较,以期为FⅧ∶C测定提供另一种可供使用的检测手段。
选取2018年1月至2019年5月于上海交通大学医学院附属瑞金医院确诊的HA患者40例(包括重型3例、中间型7例、轻型30例),获得性血友病A(AHA)患者20例,狼疮抗凝物质阳性患者20例。所有HA患者的诊断标准参考《血友病诊断与治疗中国专家共识(2017年版)》[1]。为使用发色底物法检测狼疮抗凝物质阳性伴FⅧ活性(一期凝固法)降低患者的FⅧ活性,额外收集6例狼疮抗凝物质阳性伴FⅧ活性(一期凝固法)降低患者标本。正常混合血浆由20名上海交通大学医学院附属瑞金医院同期体格检查和相关凝血检查均无异常的表观健康者血浆混合制成。所有标本来源于本实验室患者标本库,经瑞金医院伦理委员会批准[(2019)临伦审第(54)号]。
本实验使用日本Sysmex公司CS-5100全自动凝血分析仪。
Dade? Actin? FSL Activated PTT Reagent, Calcium Chloride Solution, Coagulation Factor Ⅷ Deficient Plasma和Dade? Owren′s Veronal Buffer等配套试剂均由德国Siemens公司提供。
Factor Ⅷ Chromogenic Assay和Dade? Owren′s Veronal Buffer等配套试剂均由德国Siemens公司提供。
所有患者采集枸橼酸钠抗凝(抗凝浓度为109 mmol/L,抗凝比例为1∶9)静脉血2.7 ml。1 710×g离心15 min,分离血浆供检测使用。
用厂家提供的具有溯源性的标准人类血浆定标,得到正常范围定标曲线。本实验采取6点定标。计算线性相关,要求R2≥0.99。
用厂家提供的具有溯源性的标准人类血浆稀释后定标,得到低值范围定标曲线。本实验采取5点定标。计算线性相关,要求R2≥0.99。
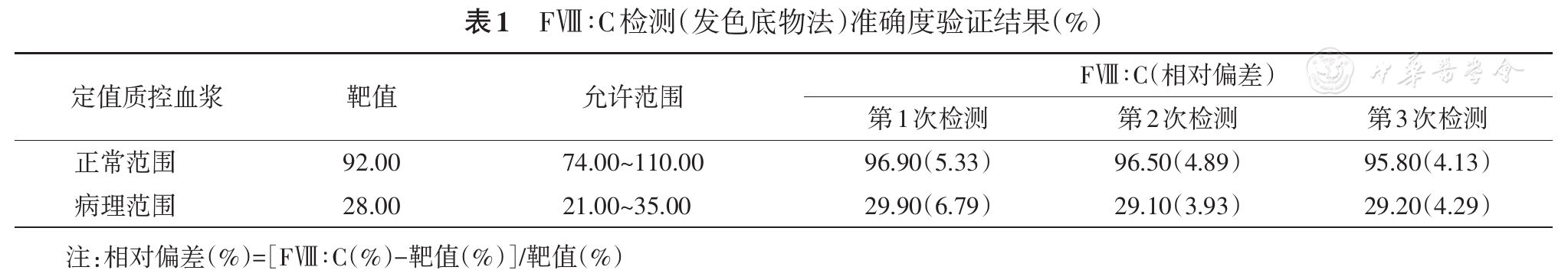
使用两个水平的定值质控品分别连续重复测定3次,测得结果必须符合厂家提供的定值范围,计算每次检测结果与靶值间的相对偏差。要求相对偏差<15%。相对偏差(%)=(测定值-靶值)/靶值×100%。
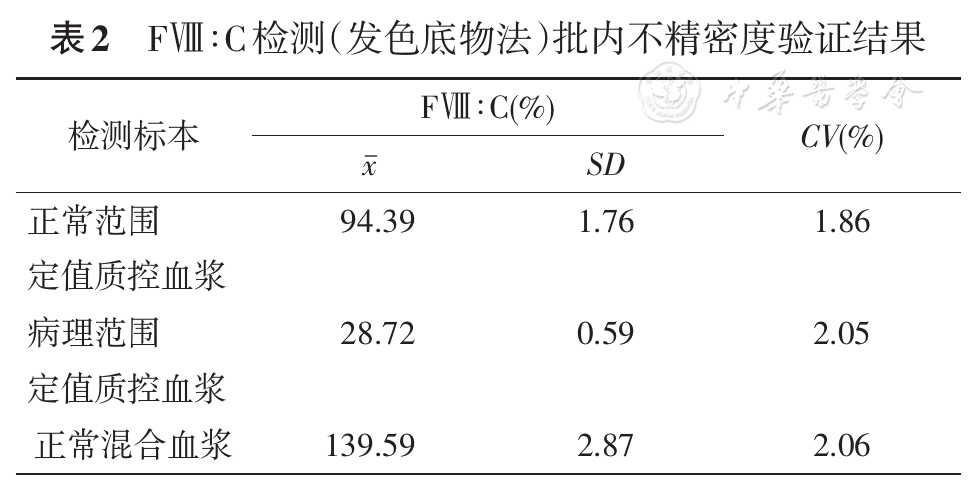
根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI) EP15-A3[9]文件,取两个水平的质控血浆及正常混合血浆,连续重复测定20次,计算算术平均值(
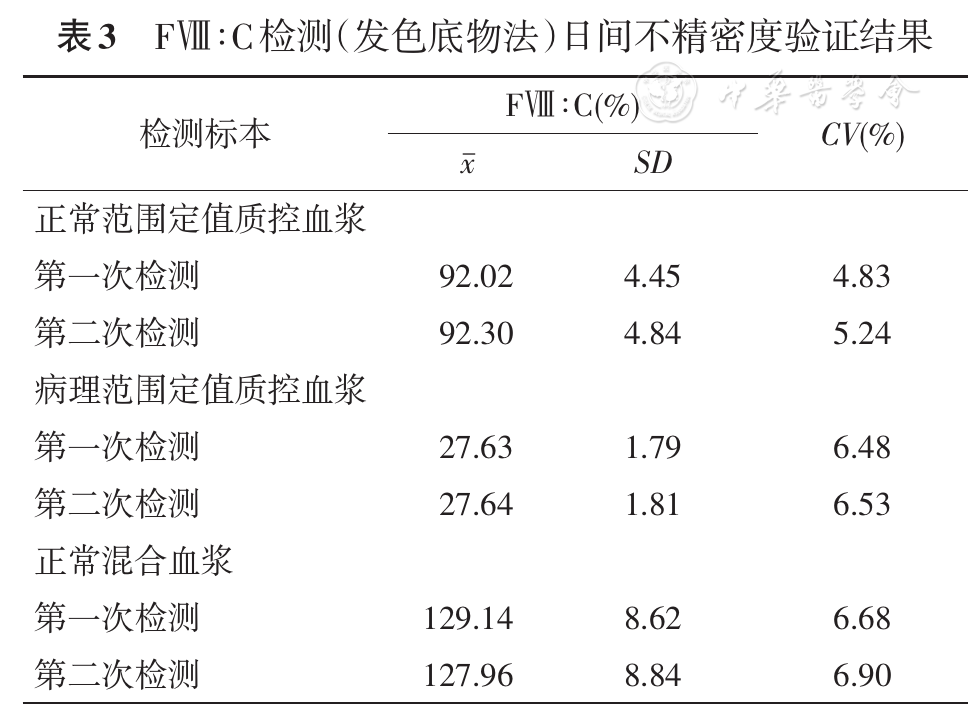
根据CLSI EP15-A3文件,取两个水平的质控血浆及正常混合血浆,分别分装成5份,冻存于-80 ℃冰箱内。每天取出3个水平的标本各1份,分别测定2次,每次测2遍,2次间隔大于2 h,共测定10 d。计算CV,判定标准为CV≤15%。
根据CLSI EP17-A2[10]文件,连续测定零水平标准品或接近零水平血浆(通过FⅧ∶C定标品稀释制得)12次,计算CV,判定标准为CV<20%。
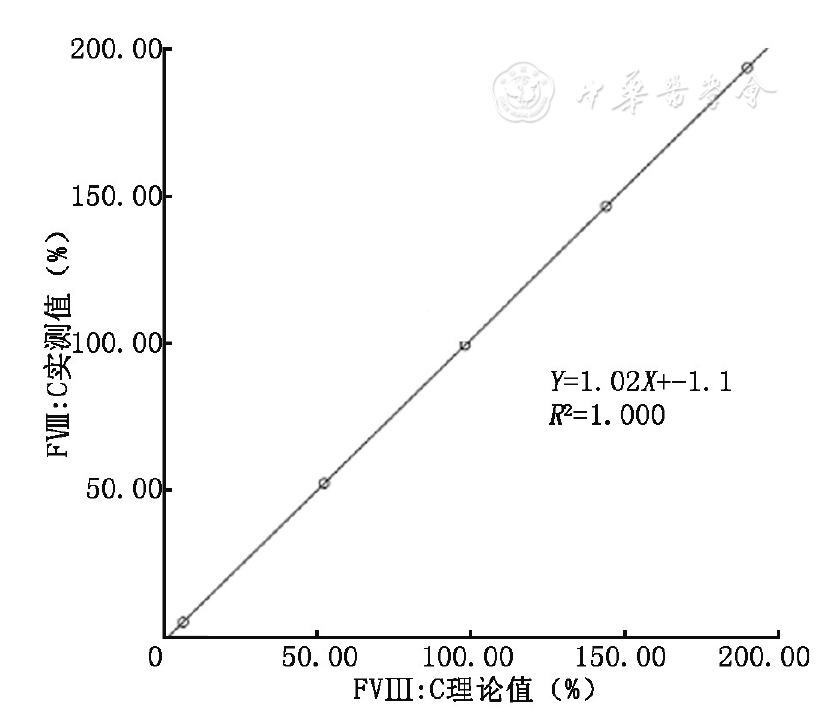
根据CLSI EP06-A[11]文件,选取一份接近预期上限的高浓度血浆(H),一份接近预期下限的血浆(L),分别按H、3H+L、2H+2L、H+3L、L的比例进行稀释,每个稀释度重复测定3次,将实测值与理论值作比较,验证线性范围。要求斜率α在1±0.05范围内,R2≥0.95。
取一份高浓度血浆连续重复测定3次,再取一份低浓度血浆连续重复测定3次。计算携带污染率(carryover rate, CR)。CR=|L1-L3|/(H3-L3)× 100%,要求CR<3%。
根据CLSI EP28-A3c[12]文件,选择同期体格检查和相关凝血检查均无异常的表观健康者60份血浆标本,分3 d检测(期间标本冻存于-80 ℃冰箱内),计算相关系数R1(R1=结果落在参考范围内的标本数/总的实验标本数),要求R1>0.90。
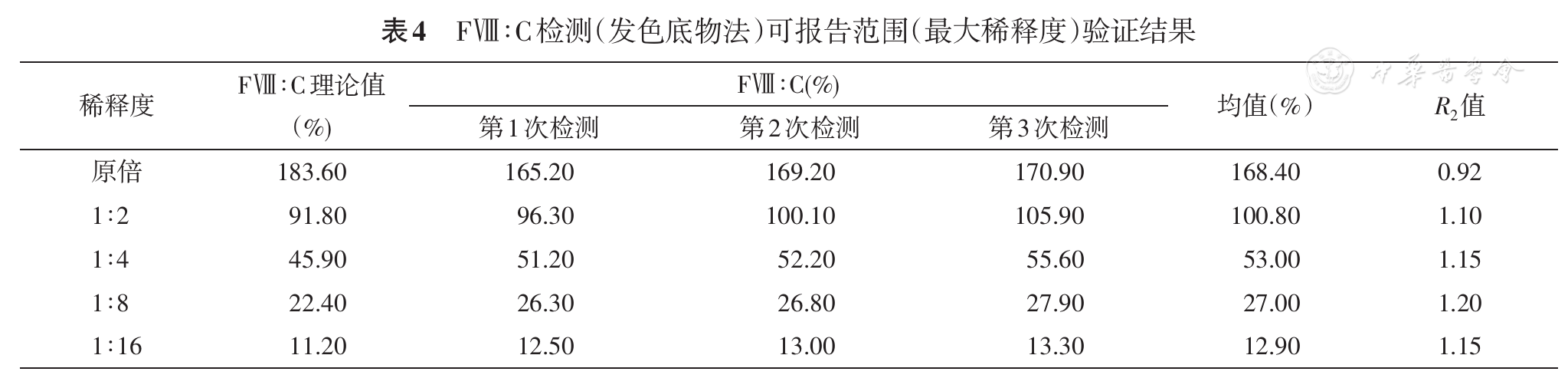
根据CLSI EP06-A文件,选取一份高浓度血浆,按照如下比例进行稀释(1∶2、1∶4、1∶8、1∶16)与原倍血浆分别连续重复测定3次,将均值与理论值进行比较得出R2。从原倍起,连续落在0.8~1.2之间的R2的最大值即最大稀释度。R2=实测值均值/理论值。
分别用FⅧ∶C检测(发色底物法)和FⅧ∶C检测(一期凝固法)检测40份HA患者标本,比较两种方法的检测结果的一致性。
分别用FⅧ∶C检测(发色底物法)和FⅧ∶C检测(一期凝固法)检测20份AHA患者标本,比较两种方法的检测结果的一致性。检测方法参考《凝血因子Ⅷ/Ⅸ抑制物诊断与治疗中国指南(2018年版)》[3]。
分别用FⅧ∶C检测(发色底物法)和FⅧ∶C检测(一期凝固法)检测20份狼疮抗凝物质阳性患者标本,比较两种方法的检测结果的一致性。
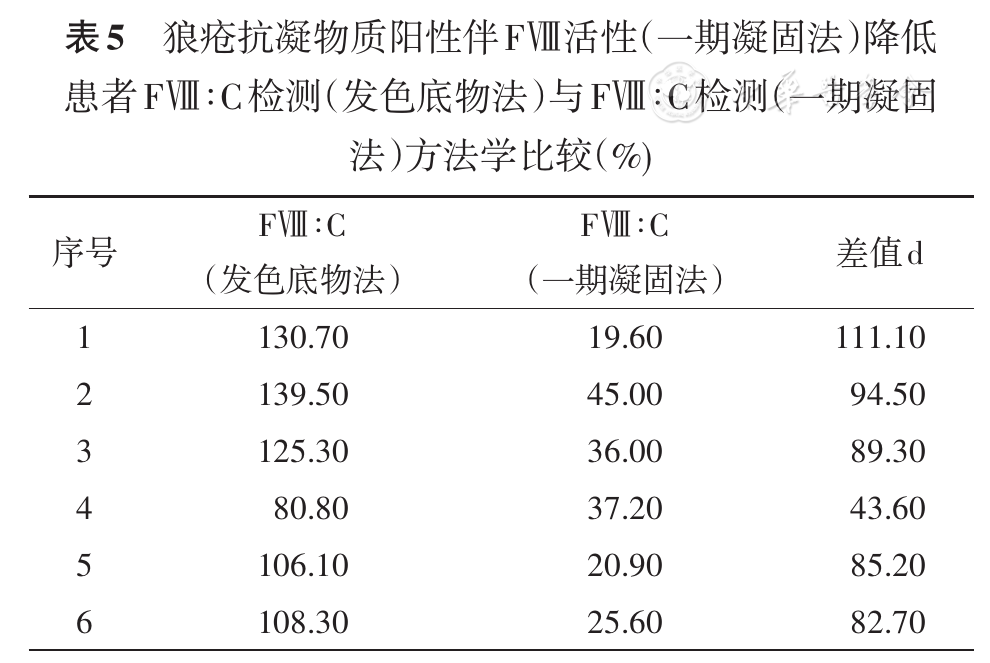
分别用FⅧ∶C检测(发色底物法)和FⅧ∶C检测(一期凝固法)检测6份狼疮抗凝物质阳性伴FⅧ活性(一期凝固法)降低患者标本,比较两种方法的检测结果的一致性。
采用SPSS 23.0软件进行统计学分析。数据均符合正态分布,以均数±标准差(
定标血浆FⅧ∶C(%)为94.00%。定标曲线见
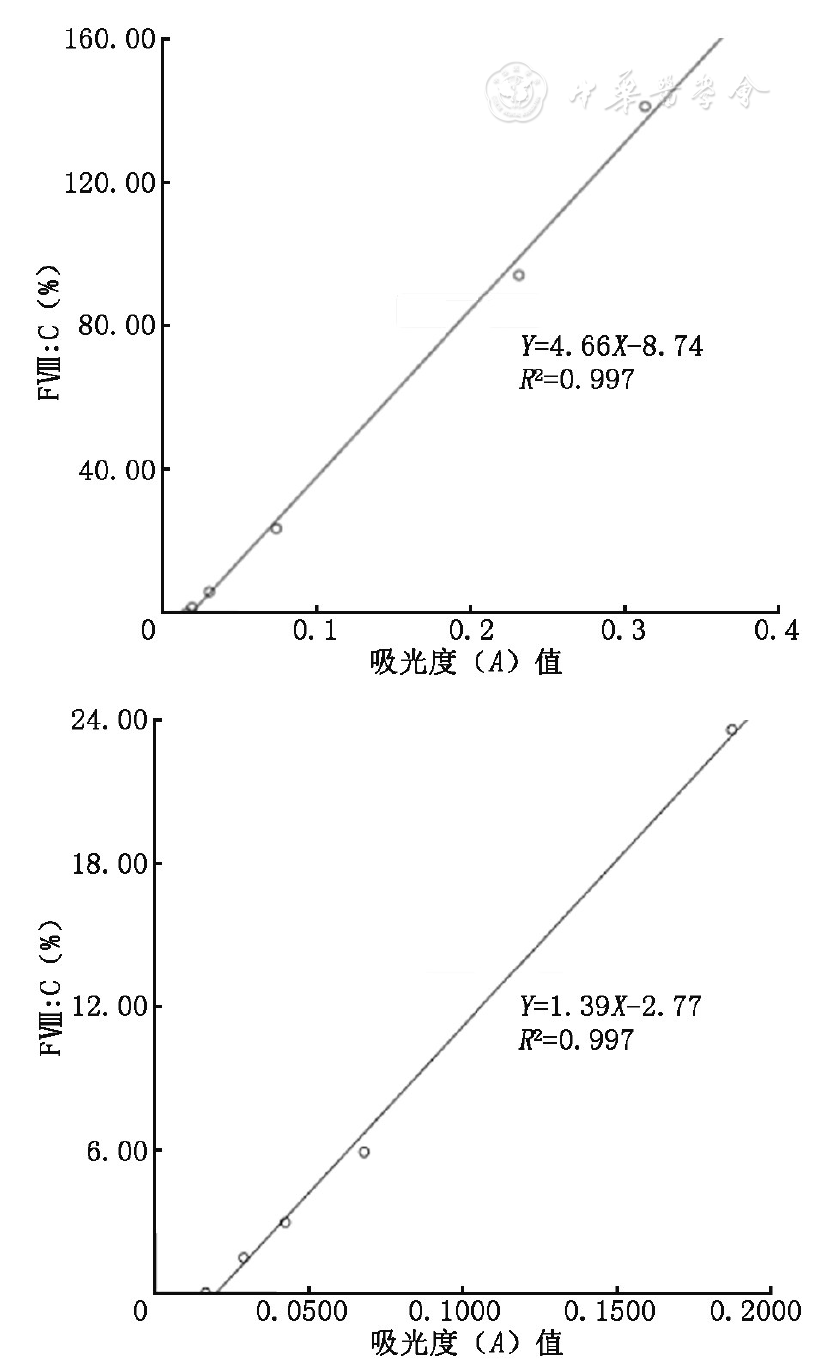
注:图A为FⅧ∶C检测(发色底物法)正常范围定标曲线;图B为FⅧ∶C检测(发色底物法)低值范围定标曲线
定标血浆FⅧ∶C(%)为94.00%。将定标血浆1∶4稀释后进行定标。定标曲线见
准确度验证结果见
批内不精密度验证结果见
日间不精密度验证结果见
接近零水平血浆FⅧ∶C(%)为(0.46±0.05)%。检测下限(灵敏度)验证结果为CV=11.23%<20%。
接近预期上限的高浓度血浆(H)FⅧ∶C(%)为190.00%,接近预期下限的血浆(L)FⅧ∶C(%)为6.00%。线性范围验证曲线见
携带污染率(CR)=|L1-L3|/(H3-L3)×100%=|5.10-5.20|/(232.20-5.20)×100%=0.04%<3%。
试剂盒说明书提供的参考范围为60.00%~168.00%。表观健康者血浆FⅧ∶C(%)为(124.96±32.00)%。60份表观健康者血浆标本中55份检测结果落在参考范围内,R1=55/60=0.92>0.90。该参考范围适用于本实验室。
接近预期上限的高浓度血浆FⅧ∶C(%)为183.60%。检测下限(灵敏度)验证结果见
方法学比较结果见
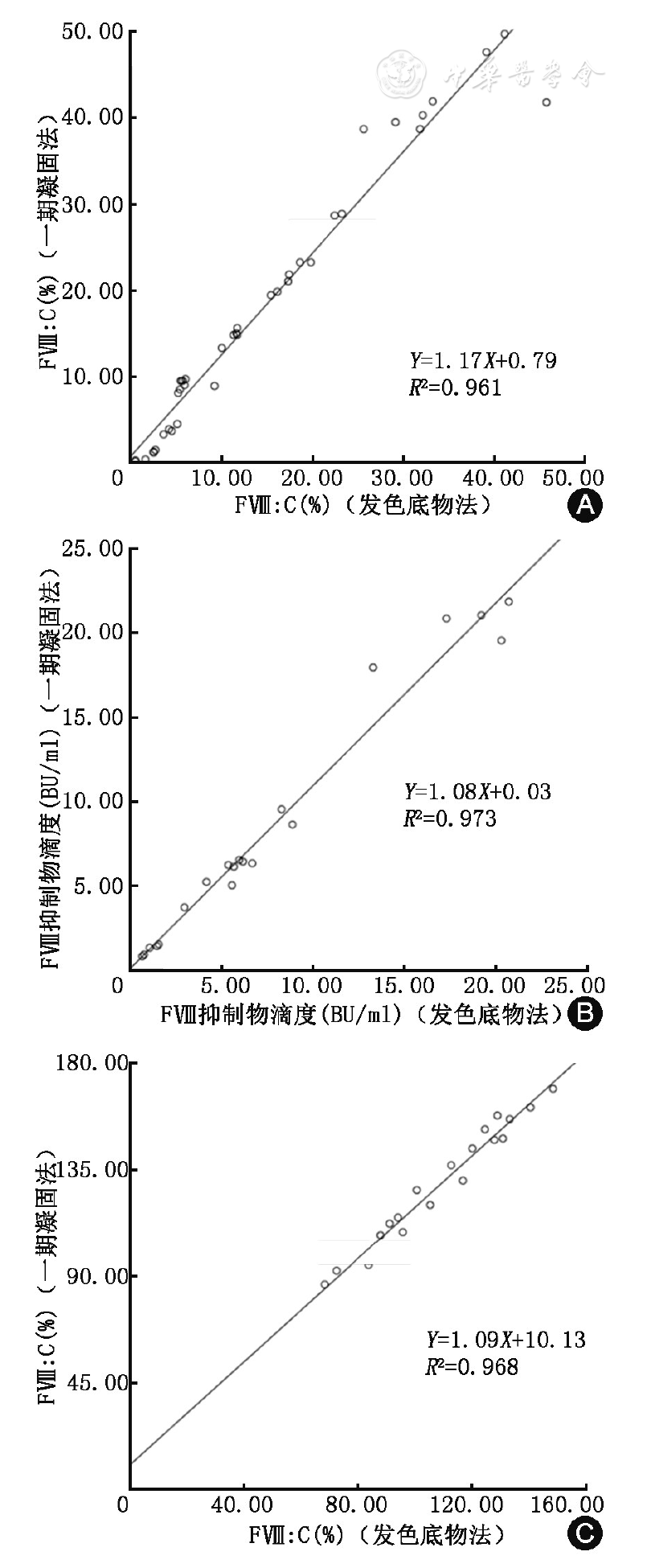
注:图A为FⅧ∶C检测(发色底物法)与FⅧ∶C检测(一期凝固法)方法学比较;图B为FⅧ抑制物滴度检测(发色底物法)与FⅧ抑制物滴度检测(一期凝固法)方法学比较;图C为狼疮抗凝物质阳性患者FⅧ∶C检测(发色底物法)与FⅧ∶C检测(一期凝固法)方法学比较
R2=0.973(
R2=0.968(
差异有统计学意义,t=9.232,P<0.05(
FⅧ∶C检测是HA患者临床诊断、治疗疗效监测、抑制物筛查等必须使用的实验室检测项目。随着临床各种血友病治疗方法的更新和普及,FⅧ∶C检测也面临着新的挑战。除了目前我国实验室最常用的检测方法——基于活化部分凝血活酶时间(activated partial thromboplastin time, APTT)的一期凝固法外,发色底物法在国外多家实验室被用于检测FⅧ∶C并已成为部分药物的实验室检测推荐方法[13]。
本研究针对FⅧ∶C检测(发色底物法)试剂盒进行了性能评价。在检测下限(灵敏度)验证时,我们按照常规定标曲线进行低值标本的FⅧ∶C检测,但一直无法获得理想的检测结果。查阅文献[14]后,同时参考一期凝固法检测低值标本的FⅧ∶C时需要采用低值范围定标曲线的做法,我们在仪器上设置了低值范围定标曲线,并对重型HA的血浆标本进行了检测,检测下限为0.50%,检测结果有很好的一致性。低值范围定标曲线很好地解决了低值标本的检测问题。
根据试剂盒提供的说明书中显示参考范围为60.00%~168.00%,我们对60份表观健康者血浆标本进行了检测,除了5份标本结果落在待验证参考范围外(检测结果分别为187.50%、181.60%、175.70%、172.80%及170.90%),其余标本均落在其中。我们进一步使用一期凝固法对该5份标本进行检测,检测结果与发色底物法的检测结果间的差异无统计学意义。根据批内不精密度验证要求(CV≤5%),我们详细询问了超出待验证参考范围上限5%(即检测结果>176.40%)的2例患者的病史,以期找出患者FⅧ∶C高于参考范围的合理解释。结合相关文献报道,我们认为出现该现象可能有以下几个原因:(1)年龄:第1份标本为老年男性,自述无出血及血栓相关病史。据文献报道,FⅧ∶C与年龄有显著正相关性[15],我们认为该患者FⅧ∶C升高可能由年龄升高造成;(2)药物:第2份标本为青年女性,自述无出血及血栓相关病史,长期口服避孕药。而国内外已有明确研究表明口服避孕药会造成FⅧ∶C升高[16]。因此,我们认为这2例患者远高于参考范围的FⅧ∶C结果真实可信,而试剂盒提供的参考范围仍适用于本实验室。
据国外文献报道,该检测方法的线性范围上限为200.00%,最大稀释度为1∶128[17]。而本实验室在验证其最大稀释度时,考虑到临床实际检测中FⅧ∶C>400.00%的情况极其少见,1∶16的稀释度已满足临床使用需求,故选择其作为最大稀释度。在制定本实验室内的临床可报告范围时,考虑到临床实际检测情况,将临床可报告范围定为0.50%~387.00%。携带污染率验证结果也进一步验证了该试剂盒的稳定性。
由于一期凝固法目前是实验室首选的FⅧ∶C检测方法,为了验证发色底物法检测结果与一期凝固法检测结果的可比性,我们分别对40份不同程度的HA患者血浆标本进行了两种方法的FⅧ∶C检测,检测结果显示两种方法的R2为0.961。本研究选取了20例AHA患者标本进行了FⅧ抑制物滴度检测,检测结果显示两种方法的R2为0.973,结论与国外文献报道一致[18]。对狼疮抗凝物质阳性患者而言,检测结果显示两种方法的R2为0.968。这说明这两种方法间的结果呈现出良好的线性关系。已有文献[17,19]报道,存在部分的FⅧ基因突变位点或狼疮抗凝物质的干扰会导致发色底物法和一期凝固法检测FⅧ∶C结果存在差异,其中狼疮抗凝物质由于具有亲磷脂的特性,而用于内源性凝血因子活性检测的一期凝固法检测试剂中含有磷脂,存在竞争性结合进而造成内源性凝血因子全系假性降低。这一问题在发色底物法中得到一定程度上地解决,可能是由于对反应的磷脂的依赖性降低[20]等多个原因造成的。本实验中对6份狼疮抗凝物质阳性伴FⅧ活性(一期凝固法)降低患者标本进行检测。6例患者既往无出血史,FⅧ∶C(发色底物法)结果均无异常。检测结果显示发色底物法可有效减少狼疮抗凝物质所致的内源性凝血因子全系假性降低现象的发生。这也提示我们可使用发色底物法检测FⅧ∶C对抗磷脂综合征和获得性血友病进行鉴别诊断。不同的FⅧ基因突变位点对两种结果的影响则是由于检测原理不同,发色底物法存在生成Ⅹa的过程,某些位点的突变可影响这一激活过程,通过影响Ⅹa的生成量导致结果存在差异,因此,我们还是需要根据患者的临床实际情况选择合适的检测方法。
综合上述性能验证结果,发色底物法检测FⅧ∶C有干扰因素少、灵敏度高等特点,可真实地反映机体FⅧ功能活性,因此我们得出结论:FⅧ∶C检测(发色底物法)试剂盒具有优越的检测性能,各方面均呈现出良好的性能评价结果,可用于FⅧ活性水平测定,且临床应用范围更广,受干扰因素少。
[1] 中华医学会血液学分会血栓与止血学组,中国血友病协作组.血友病诊断与治疗中国专家共识(2017年版)[J].中华血液学杂志, 2017, 38(5): 364-370.
[2] Srivastava A, Brewer AK, Mauser-Bunschoten EP, et al. Guidelines for the management of hemophilia[J]. Haemophilia, 2013, 19(1): e1-e47.
[3] 中华医学会血液学分会血栓与止血学组,中国血友病协作组.凝血因子Ⅷ/Ⅸ抑制物诊断与治疗中国指南(2018年版)[J].中华血液学杂志,2018,39(10):793-799.
[4] Parker ET, Healey JF, Barrow RT, et al. Reduction of the inhibitor antibody response to human factor Ⅷ in hemophilia A mice by mutagenesis of the A2 domain B cell epitope[J]. Blood, 2004, 104(3):704-710.
[5] Kitazawa T, Igawa T, Sampei Z, et al.A bispecific antibody to factors Ⅸa and Ⅹ restores factor Ⅷ hemostatic activity in a hemophilia A model[J]. Nature Medicine, 2012, 18(10):1570-1574.
[6] Muto A, Yoshihashi K, Takeda M, et al. Anti-factor Ⅸa/Ⅹ bispecific antibody ACE910 prevents joint bleeds in a long-term primate model of acquired hemophilia A[J]. Blood, 2014,124(20):3165-3171.
[7] Lenting PJ, Denis CV, Christophe OD.Emicizumab, a bispecific antibody recognizing coagulationfactors Ⅸ and Ⅹ: how does it actually compare to factor Ⅷ?[J].Blood,2017,130(23):2463-2468.
[8] Peyvandi F, Oldenburg J, Friedman KD. A critical appraisal of one-stage and chromogenic assays of factor Ⅷ activity[J]. J Thromb Haemostasis, 2016, 14(2):248-261.
[9]
[10]
[11]
[12]
[13] Jenkins PV, Bowyer A, Burgess C, et al. Laboratory coagulation tests and emicizumab treatment A United Kingdom Haemophilia Centre Doctors′ Organisation guideline[J]. Haemophilia, 2020, 26(1):151-155.
[14] Adcock DM, Strandberg K, Shima M, et al. Advantages, disadvantages and optimization of one-stage and chromogenic factor activity assays in haemophilia A and B[J]. Int J Lab Hematol, 2018,40(6):621-629.
[15] 王宗奎,窦苗苗,杜晞,等.献浆者因素及保存条件对部分凝血因子的影响[J].中国输血杂志,2016,29(9):899-901.
[16] 吴玉璘,孔志明,王心如,等.口服避孕药与凝血因子的变化及因子Ⅴ基因突变的关系[J].卫生毒理学杂志,2004,18(4):220-222.
[17] Novembrino C, Anzoletti MB, Mancuso ME, et al. Evaluation of an automated chromogenic assay for Factor Ⅷ clotting activity measurement in patients affected by haemophilia A[J]. Haemophilia, 2019,25(3):521-526.
[18] Miller CH, Rice AS, Boylan B,et al. Comparison of clot-based, chromogenic and fluorescence assays for measurement of factor Ⅷ inhibitors in the US Hemophilia Inhibitor Research Study[J]. J Thromb Haemostasis, 2013, 11(7):1300-1309.
[19] Moser KA, Funk DM. Chromogenic factor Ⅷ activity assay[J]. Am J Hematol,2014,89(7):781-784.
[20] de Maistre E, Wahl D, Perret-Guillaume C, et al. A chromogenic assay allows reliable measurement of factor Ⅷ levels in the presence of strong lupus anticoagulants[J]. Thrombo Haemostasis, 1998, 79(01):237-238.
