QuantiFERON-TB Gold Plus鉴别活动性结核病与潜伏性结核感染的潜在价值探讨
2020年9月
中华神经科杂志,第43卷第9期 第907页-第911页
唐锦华,姜申,黄嫄,黄芳,马婷婷,张彩莲,漆沄,马越云
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染引起的慢性传染性疾病,通常经呼吸道传播。据WHO报道[1],2018年全球范围内活动性结核(active tuberculosis,ATB)新发病例约1 000万,死亡近150万,约有17亿人存在Mtb感染。大多数感染者并不表现出典型的临床症状,而处于潜伏性结核感染(latent tuberculosis infection,LTBI)状态。因此,准确诊断LTBI并及时防治具有重要的临床意义。近年来,γ干扰素(interferon gamma,IFN-γ)释放试验(interferon gamma release assay,IGRA)的出现大幅度提高了Mtb感染诊断的敏感度和特异度。然而,目前IGRA方法使用的相对分子质量6 000早期分泌靶抗原(6 kDa early secretory antigenic target,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)等的传统抗原肽段只能诱导致敏的白细胞分化抗原(cluster of differentiation,CD)4+T细胞产生免疫应答,无法区分活动与潜伏两种不同的Mtb感染状态[2,3],从而给临床诊断和治疗带来了极大困扰。
研究发现,与LTBI人群相比,ATB患者特异性CD8+T细胞在外周血T淋巴细胞中所占比例更高,与Mtb载量显著相关[4,5]。基于此,QuantiFERON-TB Gold Plus(QFT-Plus)作为一种检测Mtb感染的新方法,在使用ESAT-6和CFP-10传统抗原肽段(QFT-Plus tube 1,TB1)的基础上,添加了诱导CD8+T细胞免疫应答的新抗原肽段(QFT-Plus tube 2,TB2),具有同时检测特异性CD4+和CD8+T细胞不同免疫应答来源IFN-γ的能力[6]。因此QFT-Plus不仅可以提高Mtb感染的诊断效率,同时还为鉴别不同Mtb感染状态提供了可能[7,8,9]。
本研究通过使用QFT-Plus检测LTBI与ATB两组人群中CD8+T细胞免疫应答产生的IFN-γ水平(TB2-TB1),初步探讨了QFT-Plus在鉴别诊断ATB与LTBI中的潜在应用价值。
以2019年4至11月于西安市某结核定点医院工作且身体健康的医务人员和同期住院就诊并确诊为ATB的患者为研究对象。
健康志愿者纳入标准:(1)年龄18~60周岁,男女均可;(2)既往无结核病史,目前无咳嗽、咳痰、咯血、午后低热、乏力、盗汗等ATB相关临床表现;(3)无痰涂片、胸部X线或CT等细菌学和影像学方面ATB阳性的证据。
分组标准:(1)未感染结核分枝杆菌健康对照组:符合健康志愿者纳入标准且结核感染免疫学筛查QFT-Plus检测结果为阴性者;(2)LTBI组:符合健康志愿者纳入标准且结核感染免疫学筛查QFT-Plus检测结果为阳性者[依据《中华人民共和国卫生行业标准(WS196-2017)-结核病分类》中"结核分枝杆菌潜伏感染者"分类标准];(3)ATB组:按照《中华人民共和国卫生行业标准(WS 288-2017)-肺结核诊断》中"5.3确诊病例"的诊断标准执行[即必须具有"结核分枝杆菌培养鉴定""核酸分子(DNA、RNA)扩增检测"及"GeneXpert"三项中至少一项阳性的细菌学阳性确诊依据]。
排除标准:妊娠、自身免疫功能异常(如患有影响免疫功能的疾病、服用影响免疫状态的药物等)及抗结核药物治疗时间超过2周者除外。
本研究通过了空军军医大学第一附属医院药物临床试验伦理委员会的批准(批号:KY20192083-F-1号),所有受试者均签订了知情同意书。
二级生物安全柜(德国Heraeus公司);恒温培养箱(美国Thermo Scientific公司);Infinite M200 Pro多功能酶标仪(瑞士TECAN公司);FACSCanto Ⅱ流式细胞仪(美国BD公司);结核感染体外诊断试剂盒QuantiFERON-TB Gold Plus(QFT-Plus)(德国QIAGEN公司);荧光染料偶联单克隆抗体FITC-CD3/APC-CD4/PE-CD8/PerCP-CD45四色试剂(美国BD公司)。
使用肝素抗凝管收集每名受试者至少4 ml外周静脉血,充分混匀,于采集后6 h内检测。取空白(Nil)管(阴性对照)、TB1抗原管[包含ESAT-6和CFP-10长肽段,以主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子途径刺激免疫应答]、TB2抗原管(包含与TB1相同ESAT-6和CFP-10长肽段及新添加短肽段,短肽段以MHCⅠ类分子途径刺激免疫应答)和丝裂原(Mitogen)管(阳性对照),各加入抗凝全血1 ml,震摇混匀后,于37 ℃直立孵育(20±4)h。常温3 000×g离心15 min后留取上清。取包被IFN-γ抗体的96孔板,每孔加入工作浓度的酶结合液50 μl。再分别加入Nil管、TB1管、TB2管和Mitogen管上清各50 μl。同时,加入IFN-γ标准品S1(4.0 IU/ml)、S2(1.0 IU/ml)、S3(0.25 IU/ml)、S4(0 IU/ml)及其复孔。室温下封盖孵育(120±5)min,洗板6次。加入辣根过氧化物酶显色底物溶液各100 μl,避光孵育30 min后,加入终止液各50 μl,5 min内用酶标仪于450 nm测量吸光度值。
(1)质量控制。S1平均吸光度值≥0.600;S1和S2复份吸光度值CV≤15%;S3和S4复份吸光度值变异不超过其平均值0.04;从标准品的平均吸光度值计算的相关系数(r)≥0.98。如果不符合以上标准,则测定无效。(2)定量分析,判读结果。在标准曲线合格的情况下,使用吸光度值定量计算每个反应管的IFN-γ水平。TB1或TB2任一管减去Nil管IFN-γ≥0.35 IU/ml或≥25%Nil管IFN-γ值,结果为阳性;Mitogen管IFN-γ≥0.5 IU/ml,TB1或TB2任一管减去Nil管IFN-γ<0.35 IU/ml或<25% Nil管IFN-γ值,结果为阴性;Nil管IFN-γ≥8 IU/ml或当Mitogen管IFN-γ<0.5 IU/ml,TB1或TB2任一管减去Nil管IFN-γ<0.35 IU/ml或<25%Nil管IFN-γ值时,结果为不确定,应寻找原因或重新检测。
使用FACSCantoⅡ流式细胞仪对22份细菌培养结果为"结核分枝杆菌复合群"的ATB患者进行外周血T淋巴细胞亚群分析。以CD45设门检测T淋巴细胞表面分子标记物,计算CD4+CD8-和CD4-CD8+T淋巴细胞在总CD3+T淋巴细胞中的比值。
采用SPSS 22.0软件进行统计学分析,GraphPad Prism 8.0软件绘制图表。正态分布资料以
本研究共108名健康志愿者接受了QFT-Plus筛查,按照纳入标准询问病史、检测体征及接受放射学等相关检查排除ATB后,以34例(31.5%)检测结果阳性者为"LTBI"组,以74例检测结果阴性为"健康对照"组。同时,按照ATB纳入排除标准以临床上招募的30例活动性结核病确诊患者为"ATB"组。
138例纳入研究对象的人口学特征、临床特点及分组情况见
Pearson直线相关性检验示,QFT-Plus新添加抗原刺激IFN-γ释放水平(TB2-TB1)与CD8+T细胞在总T淋巴细胞中所占比例呈正相关(r=0.586,P=0.004),与CD4+T细胞在总T淋巴细胞中所占比例及CD4/CD8的比值呈负相关(r=-0.511,P=0.015及r=-0.520,P=0.013),表明TB2-TB1水平随ATB患者外周血CD8+T细胞免疫应答水平升高而升高。
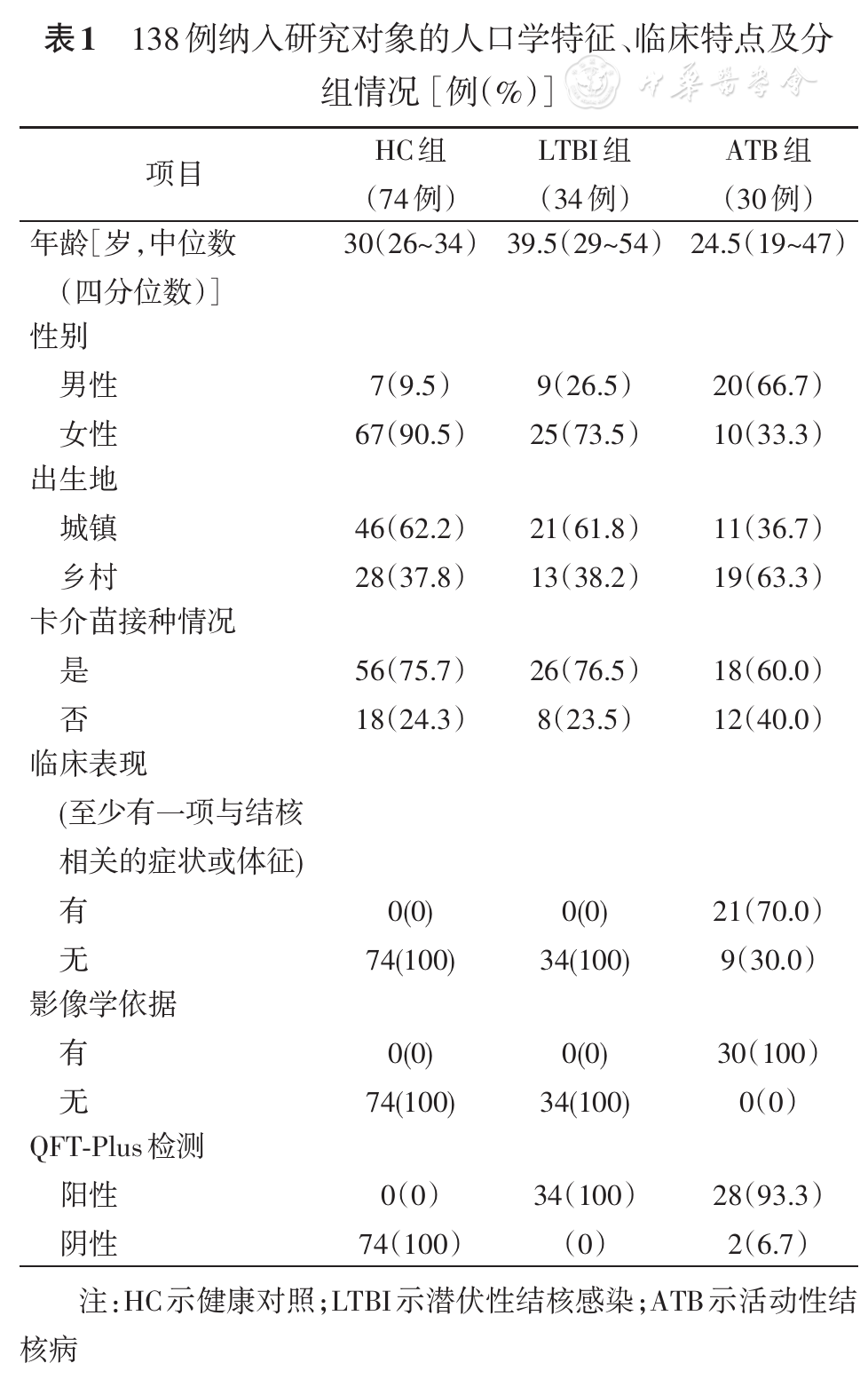
QFT-Plus检测结果各指标(TB1-Nil、TB2-Nil及TB2-TB1)以中位数(四分位数)表示,LTBI组分别为1.38(0.68,4.26)、0.99(0.81,3.54)及0.01(-0.08,0.22)IU/ml,ATB组分别为2.04(0.73,4.91)、2.66(1.14,5.71)及0.47(0.12,1.17)IU/ml,见
注:图1A示TB1减空白对照后IFN-γ水平;图1B示TB2减空白对照后IFN-γ水平;图1C示TB2减TB1后IFN-γ水平。LTBI示潜伏性结核感染组;ATB示活动性结核病组;TB2-TB1示QFT-Plus特异性CD8+T细胞免疫应答,即TB2减TB1后IFN-γ水平;IFN-γ示γ干扰素
分别绘制QFT-Plus TB1-Nil、TB2-Nil及TB2-TB1鉴别诊断ATB与LTBI的ROC曲线(
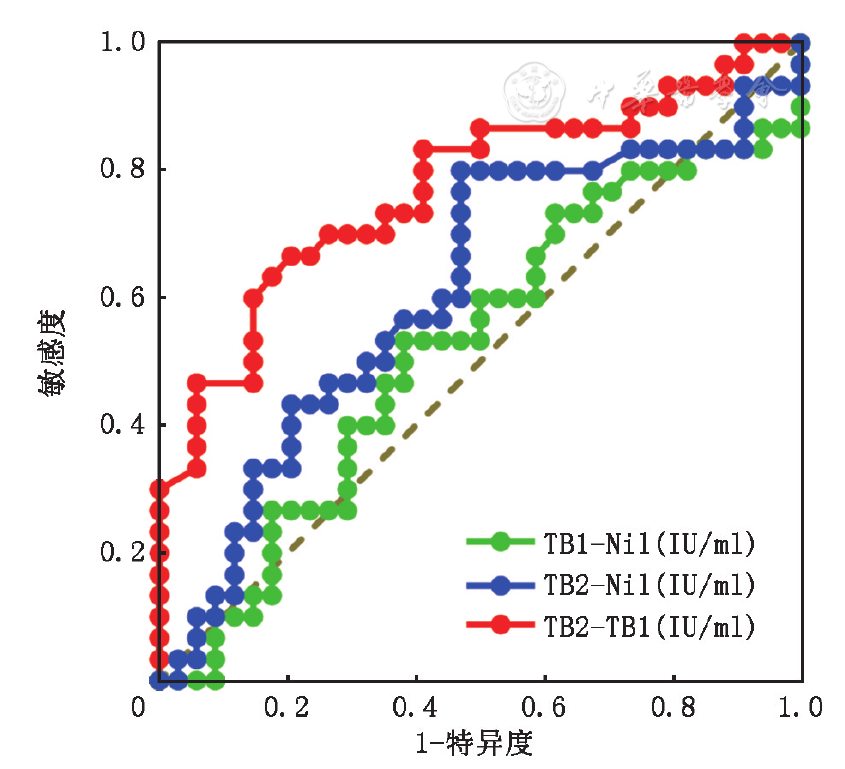
注:图中虚线为参考线。TB1-Nil示TB1减空白对照后IFN-γ水平,TB2-Nil示TB2减空白对照后IFN-γ水平,TB2-TB1示QFT-Plus特异性CD8+T细胞免疫应答,即TB2减TB1后IFN-γ水平,ATB示活动性结核病,LTBI示潜伏性结核感染,ROC示受试者工作特征
由Youden指数计算得,TB2-TB1最佳截断水平为0.305 IU/ml。在该水平下,鉴别诊断敏感度为66.7%(20/30),特异度为79.4%(27/34),阳性预测值和似然比分别为74.1%(20/27)和3.24,阴性预测值和似然比分别为73.0%(27/37)和0.42,正确率为73.4%(47/64)。
结核感染和发病机制复杂,受遗传背景、营养条件、环境因素等多方面影响[10]。在IGRA被广泛应用于临床以后,人们发现,要从数量庞大的Mtb感染人群中筛查出ATB患者进行分类治疗并非易事。近年研究表明,CD8+T细胞在活动性结核发病过程中发挥着重要作用。不论是在新近暴露的成人或儿童,还是HIV感染者中,Mtb特异性CD8+T细胞均与ATB的发生关系密切[11,12]。Rozot等[4]研究发现,ATB患者外周血中Mtb特异性CD8+T细胞数量明显高于LTBI人群,通过比较Mtb感染者外周血T淋巴细胞中CD8+T细胞所占的比例有助于鉴别ATB与LTBI。同时,前瞻性队列研究表明这种比例的升高会伴随抗结核治疗而快速下降,CD8+T细胞变化有望成为疗效监测的替代指标[13]。
QFT-Plus作为首款使用CD8+T细胞特异性抗原的IGRA方法,2015年一经问世就获得了研究者们的广泛关注。Petruccioli等[6]报道了CD4+和CD8+T细胞对QFT-Plus使用抗原的反应特性,认为TB1主要诱导CD4+T细胞产生免疫应答,而TB2可以诱导CD4+和CD8+T细胞共同产生免疫应答,且TB2诱导的CD8+T细胞免疫应答水平很大程度上与活动性相关。Barcellini等[8]分析了两个抗原管之间产生IFN-γ水平的差值(即TB2-TB1),并将其作为特异性CD8+T细胞的免疫应答水平来间接估计人群近期暴露风险。而后,Lee等[9]发现TB2-TB1水平在ATB患者中明显高于LTBI人群。
本研究提示,单独应用QFT-Plus TB1或TB2管产生的IFN-γ水平并不能有效区分ATB与LTBI两种不同的Mtb感染状态(
本研究尚存一些不足之处。首先,受不同人群客观条件和地域分布的影响,研究对象的纳入和分组在年龄、性别等方面存在一些偏倚。其次,本实验招募的ATB患者由于病情严重程度不同,也影响了检测结果的准确性。为求得更加符合实际情况的结论,有必要进一步扩大样本量,并开展前瞻性应用研究,为临床应用提供更加准确的判断依据。
[1]
[2] Pai M, Denkinger CM, Kik SV, et al. Gamma interferon release assays for detection of
[3] Goletti D, Sanduzzi A, Delogu G. Performance of the tuberculin skin test and interferon-gamma release assays: an update on the accuracy, cutoff stratification, and new potential immune-based approaches[J]. J Rheumatol Suppl, 2014,91:24-31.
[4] Rozot V, Patrizia A, Vigano S, et al. Combined use of Mycobacterium tuberculosis-specific CD4 and CD8 T-cell responses is a powerful diagnostic tool of active tuberculosis[J]. Clin Infect Dis, 2015,60(3):432-437.
[5] Day CL, Abrahams DA, Lerumo L, et al. Functional capacity of Mycobacterium tuberculosis-specific T cell responses in humans is associated with mycobacterial load[J]. J Immunol, 2011,187(5):2222-2232.
[6] Petruccioli E, Chiacchio T, Pepponi I, et al. First characterization of the CD4 and CD8 T-cell responses to QuantiFERON-TB Plus[J]. J Infect, 2016,73(6):588-597.
[7] Sotgiu G, Saderi L, Petruccioli E, et al. QuantiFERON TB Gold Plus for the diagnosis of tuberculosis: a systematic review and meta-analysis[J]. J Infect, 2019,79(5):444-453.
[8] Barcellini L, Borroni E, Brown J, et al. First evaluation of QuantiFERON-TB Gold Plus performance in contact screening[J]. Eur Respir J, 2016,48(5):1411-1419.
[9] Lee MR, Chang CH, Chang LY, et al. CD8 response measured by QuantiFERON-TB Gold Plus and tuberculosis disease status[J]. J Infect, 2019,78(4):299-304.
[10] Lawn SD, Zumla AI. Tuberculosis[J]. Lancet, 2011,378(9785):57-72.
[11] Nikolova M, Markova R, Drenska R, et al. Antigen-specific CD4-and CD8-positive signatures in different phases of Mycobacterium tuberculosis infection[J]. Diagn Microbiol Infect Dis, 2013,75(3):277-281.
[12] Lancioni C, Nyendak M, Kiguli S, et al. CD8+T cells provide an immunologic signature of tuberculosis in young children[J]. Am J Respir Crit Care Med, 2012,185(2):206-212.
[13] Nyendak MR, Park B, Null MD, et al. Mycobacterium tuberculosis specific CD8(+) T cells rapidly decline with antituberculosis treatment[J]. PLoS One, 2013,8(12):e81564.
[14] Jasenosky LD, Scriba TJ, Hanekom WA, et al. T cells and adaptive immunity to
[15] Pieterman ED, Liqui Lung FG, Verbon A, et al. A multicentre verification study of the QuantiFERON?-TB Gold Plus assay[J]. Tuberculosis, 2018,108:136-142.
[16] Metcalfe JZ, Cattamanchi A, McCulloch CE, et al. Test variability of the QuantiFERON-TB gold in-tube assay in clinical practice[J]. Am J Respir Crit Care Med, 2013,187(2):206-211.
