系统性红斑狼疮生物标志物临床应用进展
2020年9月
中华神经科杂志,第43卷第9期 第939页-第944页
詹皓婷,李永哲
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种因免疫耐受机能丧失所致的自身免疫性疾病,常见累及肾脏、中枢神经系统、血管及心脏等。SLE患者常出现T、B淋巴细胞的功能紊乱,因不同自身抗体合成过度,引起免疫复合物在特定部位沉积,带来不同程度的组织器官损伤,体现出与基因和环境风险因素相关的异质性,使SLE的诊断较为困难。目前,该疾病主要依靠其临床症状、实验室指标来进行诊断与监测。近年,SLE新型生物标志物不断发现;新型检测技术和方法的发展,SLE免疫学指标检测由定性转变为定量,并在疾病诊断、治疗、预后监测中发挥着重要的作用。本文将结合SLE分类标准中的实验室免疫学指标,基于SLE的临床亚型对新发现的生物标志物及其临床应用展开综述。
1982年SLE分类标准是从30个不同标准中分析得出[1]。该标准对SLE诊断的敏感度与特异度均为96%,见

1997年ACR对1982年的SLE分类标准作出修改[2]。在免疫学诊断指标方面,抗核抗体从定性水平变为定量水平"抗核抗体滴度异常",降低该标准的敏感度至83%。标准增加抗磷脂抗体(antiphospholipid antibody,APL)阳性[包括抗心磷脂抗体(anticardiolipin antibody,ACA),或狼疮抗凝物(lupus anticoagulant,LA),或至少持续6个月的梅毒血清试验假阳性三者中具备一项阳性],使特异度降低为93%。
2009年SLICC标准更加注重临床与免疫学的结合诊断,强调将肾活检作为独立标准,提出SLE确诊条件"肾活检证实为狼疮性肾炎且抗核抗体(antiuclear anntibody,ANA)或抗双链DNA(double-stranded DNA,dsDNA)抗体阳性"或"满足该标准内容至少4条(包括至少1条临床标准和至少1条免疫学标准)"[3]。在免疫学标准方面:(1)严格界定了抗dsDNA抗体的阳性标准:采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)法检测时至少两次阳性;(2)在抗磷脂抗体中,增添了抗β2GP1抗体(anti-beta 2 glycoprotein 1 antibody,Aβ2GP1)阳性标准,并将ACA滴度异常限定在中高阳性水平;(3)新纳入"补体水平包括C3/C4/血清总补体活性(complement hemolysis 50%,CH50)降低"与"抗人球蛋白试验阳性"。与1997年ACR分类标准对比,SLICC 2009年分类修订标准有较高的敏感度(97%/83%),但是特异度欠佳(84%/93%)。
EULAR/ACR 2019分类标准新增加抗核抗体为SLE入围标准,强调了ANA在诊断SLE的重要性:ANA滴度曾≥1∶80(HEp-2细胞作为底物,间接免疫荧光法检测),凡是ANA不符标准的不考虑SLE诊断[3,4]。在免疫学维度方面,标准作出以下变动:(1)增加高特异性抗dsDNA抗体与抗sm抗体的计分权重;(2)完善APL诊断的定量标准:ACAIgG>40 GPL或抗β2GP1 IgG>40 GPL;(3)区分补体降低的计分标准:C3或C4下降评为3分,C3和C4下降评为4分。该分类标准具有更高的诊断敏感度(98%)和特异度(96%)。
LN发生在约50%的SLE疾病进程中[5],发病机制主要是免疫复合物在肾脏沉积,造成肾小球损伤,引起肾炎及肾脏衰竭。目前广泛采用2003年国际肾病学会/肾脏病理学会(International Society of Nephrology/Renal Pathology Society,ISN/RPS)分型体系共6个病理分型。肾脏活检穿刺是LN确诊分型的金标准,但LN免疫学诊断指标的检测能减少患者创伤并且辅助疾病的早期诊断、治疗与预后。
抗dsDNA抗体极少见于其他疾病患者,滴度随SLE疾病活动度发生波动,导致肾损害的频率最高[6,7]。Bizzaro等[8]荟萃分析发现,抗dsDNA抗体诊断SLE的合成敏感度与特异度分别为52.4%与94.2%,阳性似然比为12.7,高特异度和阳性似然比表明其可作为SLE的特异性诊断指标。Jia等[9]研究发现,IgM型抗dsDNA与SLE相关肾脏损伤显著相关;ELISA法测定免疫球蛋白M(immunoglobulin M,IgM)型抗dsDNA阴性诊断LN的敏感度、特异度、阳性预测值、阴性预测值分别为70%、59%、69%、64%,比值比(odds ratio,OR)为3.316,见
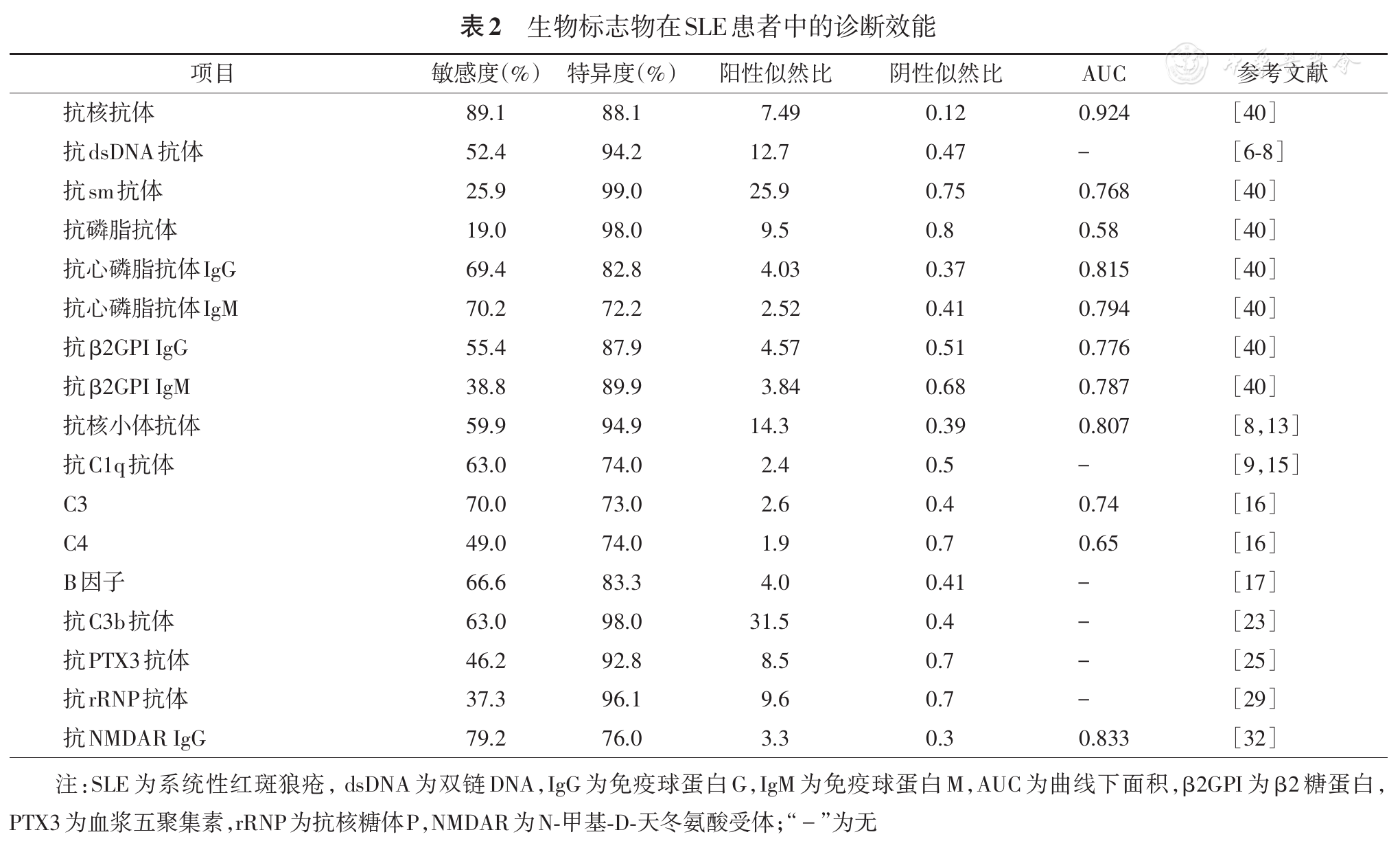
抗核小体抗体(anti-nucleosome antibody,ANuA)可与组蛋白-DNA复合物反应,显示抗dsDNA抗体阴性SLE患者的肾脏进展,但不能有效区分活动期和非活动期LN[8,11]。ANuA存在于60%~90%的LN患者体内,与肾脏疾病恶化有关[7,8]。meta分析显示,ANuA比抗dsDNA抗体有更好的敏感度(59.9%/52.4%)、阳性似然比(14.3/12.7)、阴性似然比(0.39/0.47)与诊断比值比(OR:41.0/27.8),二者的特异度基本持平(94.9/94.2)[8]。ANuA具有更优秀的SLE诊断效能。用ELISA法检测该抗体[12],其诊断LN的敏感度为87.5%,特异度为75%,AUC为0.807;与抗C1q抗体结合检测阳性时诊断效能较单独检测显著上升(OR:26.66/22.17),提示ANuA与抗C1q抗体结合检测能有效提高抗体诊断效能和更好地预示LN疾病风险。ANuA与SLE疾病活动指数呈正相关,可以作为SLE疾病活动度的预测因子,关注病情进展。
C1q参与经典激活途径中凋亡细胞与炎症的清除。抗C1q抗体与C1q结合阻碍自身抗原的清除,触发SLE。40%~100%的LN患者血清有抗C1q抗体[13],并显著升高[14]。Jia等[9]单独应用抗C1q抗体诊断SLE时,其敏感度为63%,特异度为74%;抗C1q抗体与抗dsDNA抗体联合检测诊断特异性会提高至79%~90%;提示LN相关抗体的联合检测可以显著提高诊断效能。抗C1q抗体不仅与SLE疾病活动度相关,还是体现疾病疗效的有效指标:一旦患者接受有效治疗,其滴度呈明显趋下降势至无法检出,但其与SLE严重程度没有关联[15]。
补体成分测定对SLE诊断与监测尤为重要。血清补体水平降低与SLE疾病活动度相关,C3、C4的降低可以作为活动性SLE及疾病恶化的标志物[16]。Birmingham等[16]分析了C3或C4在诊断LN恶化的价值,结果显示C3、C4的敏感度、特异度、AUC分别为70%/49%,73%/74%和0.74/0.65。因此,C3、C4作为独立的指标诊断LN作用较弱。C3、C4的阳性预测值和阴性预测值分别为22%/17%和97%/95%,提示正常的C3、C4水平用于排除LN病情恶化。目前临床医生仍然依赖血清补体C3、C4水平降低作为指示SLE病情恶化及弥漫性增生性LN的敏感指标。
血清补体B因子(complement factor B,CFB)参与补体激活替代途径,介导破坏病原体及凋亡细胞过程,B因子在LN致病进程中的重要作用,是预测LN结局的重要危险性因子[18]。Bb因子在活动期LN体内显著升高,鉴别诊断活动性的LN时的敏感度和特异度分别为66.6%和83.3%,阳性似然比为3.95,显示Bb有较强的辨别活动期LN特异度,相较传统诊断指标可作鉴别诊断疾病活动期LN的有效补充性指标。
血清补体H因子(complement factor H,CFH)可加速替代途径C3转化酶的衰变,调节补体活化过程及保护宿主细胞免受意外的免疫损伤。H因子与SLE疾病活动评分(Systemic Lupus Erythematosus Disease Activity Index,SLEDAI)呈负相关,LN不同病理学类别患者血清CFH水平存在显著差异,临床补充检测可辅助病理学分类、辨别LN疾病进程及活动度[19]。患者H因子水平在LN活动期以及ANA和抗dsDNA抗体指标阳性显著降低,缓解期显著增加[20],提示其可能为LN疾病的保护性因子。抗H因子抗体在6.7%的SLE患者血清中被检出且倾向于在更高疾病活动度时出现,目前尚无研究发现其与LN疾病相关[21]。
C3b作为补体活化级联反应的枢纽分子,其功能缺陷、数量异常会导致SLE发生[22]。Birmingham等[23]的前瞻性研究发现IgG抗C3b存在约24%的LN患者体内,其诊断LN的敏感度和特异度分别为63%和98%。抗C3b抗体的的优势在于其敏感度和特异度均高,可作为高度特异性指标独立应用于LN的诊断中。此外,抗C3b抗体阳性与LN的复发相关,复发时抗C3b抗体滴度有升高趋势且在4~6个月期间出现抗C1q抗体滴度升高,提示联合检测两抗体可能更有助于预测LN的病情进展及评估预后。
Pentraxin 3由炎症部位活化的肾小球系膜细胞和肾小管上皮细胞释放并参与补体激活和C1q清除,与SLE疾病活动度和LN严重程度密切相关[24,25,26]。患者血清中PTX3显著降低、抗PTX3抗体显著升高[27],PTX3可能在LN中起保护作用。抗PTX3抗体诊断LN的敏感度和特异度分别为46.2%、92.8%,该抗体可作为诊断LN的特异性指标;当与抗C1q抗体结合检测时,其可作为补充性指标提高LN患者检出率。近期研究发现抗PTX3抗体与经典SLE生物标志物存在显著相关性。抗PTX3抗体阴性且PTX3水平较高的LN患者更倾向具有尿蛋白、血清肌酐升高的严重肾损伤及微血管血栓症状[24,26]。这提示抗PTX3抗体与PTX3的检测具有潜在的诊断价值,能够作为补充性指标显示及预测狼疮性肾炎的疾病活动度与严重程度。
NPSLE是SLE侵犯中枢神经系统,引起的神经系统病变和精神障碍。25%~75%的SLE患者具有中枢神经器质性损害、周围神经病变及精神性病变等症状[28]。磁共振成像和核医学技术可以很好地表征SLE患者的结构与功能异常;NPSLE患者血清或脑脊液中存在数十种针对神经元及细胞及胞质、细胞因子、补体的疾病相关抗体,但相关免疫学标志物的产生、致病机制、疾病关联及诊断效能尚不明确,需完善。
抗核糖体P(ribosomal P,rRNP)抗体在12%~38%的SLE患者中发现在活动性SLE滴度显著升高并与精神病及严重抑郁症发作密切相关,在脑脊液中的检测较血清中更为准确[29]。Hirohata等[27]发现抗rRNP抗体诊断SLE时的敏感度和特异度分别为37.3%和96.1%,较ACA和抗sm抗体敏感度高,特异性与抗dsDNA抗体和抗sm抗体均等;在抗dsDNA抗体、抗Sm抗体或aCL阴性的患者体内也检测到抗rRNP抗体。因此,抗rRNP抗体诊断SLE的特异性高且诊断效能优于传统指标抗心磷脂抗体和抗sm抗体,其可作补充性参数用于提高SLE诊断的准确性。相关meta分析评价了抗rRNP抗体对NP SLE的诊断效能:对于诊断神经病或情绪障碍或二者兼有,其敏感度和特异度分别为27%和80%;对于诊断其他弥漫性NPSLE,其敏感度和特异度分别为24%和80%,由此抗rRNP抗体能特异性识别疾病临床表型,但对疾病并不敏感[30]。目前抗rRNP抗体检测方法尚未统一,阳性率受检测方法的影响,利用人源蛋白抗原检测抗rRNP抗体的敏感度大于小牛血清抗原检测。
N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)包含NR1、NR2、NR3,其功能活性会影响认知学习与记忆。抗NMDAR抗体,一种与NMDAR产生交叉反应的抗dsDNA抗体,可促进神经兴奋性中毒或凋亡。30%~40%的NPSLE患者体内可检出抗NMDAR抗体且滴度显著升高,表现中枢神经系统症状或神经精神系统性功能紊乱的SLE患者拥有更高滴度[31]。抗NMDAR抗体对出现认知功能障碍的SLE患者诊断敏感度高且诊断效能好;其与抗dsDNA抗体、C3、C4、ANA、抗Sm抗体、抗U1RNP抗体缺乏相关性[32],可试作独立诊断指标。此外,中枢神经系统的抗NMDAR抗体水平与NPSLE患者神经病学与其智能量表评分呈负相关[31]。因此,将抗NMDAR抗体检测应用于早期诊断可以有效地发现神经元损伤、认知障碍的患者,以及时治疗控制疾病。相关荟萃分析表明:抗NR2抗体(IgG型)与抗dsDNA抗体、SLEDAI、补体C3、C4水平呈正相关,对NPSLE有一定诊断价值(OR=1.607),但缺乏不同症状间的明显差异[33]。在血清和脑脊液中弥漫性NPSLE患者的抗NR1抗体水平显著增高,其在血清中弥漫性和局灶性患者水平均高,而在脑脊液中弥漫性则显著高于局灶性,提示抗NR1抗体血清与脑脊液的检测可用于区分弥漫性与局灶性的NPSLE。目前已存在检测抗NMDAR抗体的试剂盒。
系统性红斑狼疮会增加患心血管疾病的风险。约有32%的SLE患者出现动脉粥样硬化,其缺血性卒中和心肌梗死(myocardial infarction,MI)的发生率是健康人群的3倍,呈现出更高的CVD死亡率。
磷脂酰胆碱(phosphatidycholine,PC)在获得抗原性后刺激产生并分泌抗PC抗体,高水平的anti-PC可作动脉粥样硬化保护性标志物。研究显示IgM anti-PC水平在SLE中显著下降,使用IgM anti-PC/总IgM比值诊断颈动脉斑块形成的敏感度为41%,特异度为85%,AUC为0.67,提示IgM anti-PC是诊断SLE相关亚临床动脉粥样硬化表现的特异性指标[34]。anti-PC与传统CVD诊断指标有较紧密的关联:IgM anti-PC与SLE患者的甘油三酯和低密度脂蛋白呈负相关,与高密度脂蛋白呈正相关。IgG/IgM anti-PC比值上升并与SLEDAI呈正相关[35]。因此,它可用于监测SLE活动度,并预测患者动脉粥样硬化以及CVD危险性。
aPL包括aCL、aβ2GPI和LA,可通过活化内皮细胞、血小板及发挥对天然LA的抵抗性来促使SLE相关血栓事件的发生[36]。aPL在40%~60%的SLE患者体内被检为阳性并与血栓形成风险密切相关,它可在患者体内持续性存在、保持中高滴度且出现三重检测区带阳性,后期可继发抗磷脂综合征。aPL出现三重检测区带阳性时诊断血栓事件的敏感度、特异度、阳性预测值分别为19%、98%、92%,AUC为0.58[36]。因此,aPL三区带阳性是诊断SLE相关血栓事件的特异性指标,三区带阳性出现基本可判断血栓发生,反之可排除。aCL与aβ2GPI为诊断血栓症和APS的特异性指标,但敏感度较差,其中抗β2GPI IgM最强[37]。LA和抗RNP/sm抗体同时阳性是静脉血栓事件发生的危险因素,两项指标联合检测的特异度、阳性预测值与阳性似然比均有所上升,提高了诊断SLE静脉血栓事件的准确性[38,39]。
SLE生物标志物的发现与临床应用推动了早期诊疗进展。多数生物标志物呈现与SLE致病机制、临床表型以及病情进展的关联,其产生机制的深入研究也为临床免疫学治疗提供了努力的方向。发现新型生物标志物的作用机制;明确与疾病的关联与诊断效能;寻找提高疾病诊断敏感度与特异度的方法;制定免疫学治疗方案等更值得深入研究。SLE新型生物标志物距临床诊断应用还有距离,随着相关研究的不断开展,将在疾病的临床精准分型、诊断和个体化治疗上发挥重要作用。
[1] Davatchi F, Chams C, Akbarian M. Evaluation of the 1982 American Rheumatism Association revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1985,28(6):715.
[2] Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1997,40(9):1725.
[3] Petri M, Orbai AM, Alarcón GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus[J]. Arthritis Rheum, 2012,64(8):2677-2686.
[4] Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus[J]. Ann Rheum Dis, 2019,78(9):1151-1159.
[5] Hanly JG, O′Keeffe AG, Su L, et al. The frequency and outcome of lupus nephritis: results from an international inception cohort study[J]. Rheumatology (Oxford), 2016,55(2):252-262.
[6] Dema B, Charles N. Autoantibodies in SLE: specificities, isotypes and receptors[J]. Antibodies (Basel), 2016,5(1).
[7] Haller-Kikkatalo K, Alnek K, Metspalu A, et al. Demographic associations for autoantibodies in disease-free individuals of a European population[J]. Sci Rep, 2017,7:44846.
[8] Bizzaro N, Villalta D, Giavarina D, et al. Are anti-nucleosome antibodies a better diagnostic marker than anti-dsDNA antibodies for systemic lupus erythematosus? A systematic review and a study of metanalysis[J]. Autoimmun Rev, 2012,12(2):97-106.
[9] Jia Y, Zhao L, Wang C, et al. Anti-double-stranded DNA isotypes and anti-C1q antibody improve the diagnostic specificity of systemic lupus erythematosus[J]. Dis Markers, 2018,2018:4528547.
[10] de Leeuw K, Bungener L, Roozendaal C, et al. Auto-antibodies to double-stranded DNA as biomarker in systemic lupus erythematosus: comparison of different assays during quiescent and active disease[J]. Rheumatology (Oxford), 2017,56(5):698-703.
[11] Soliman S, Mohan C. Lupus nephritis biomarkers[J]. Clin Immunol, 2017,185:10-20.
[12] ML? G, Khoury M, Gómez G, et al. Cut-off values of immunological tests to identify patients at high risk of severe lupus nephritis[J]. Medicina (B Aires), 2018,78(5):329-335.
[13] Dumestre-Pérard C, Clavarino G, Colliard S, et al. Antibodies targeting circulating protective molecules in lupus nephritis: Interest as serological biomarkers[J]. Autoimmun Rev, 2018,17(9):890-899.
[14] Stegert M, Bock M, Trendelenburg M. Clinical presentation of human C1q deficiency: how much of a lupus?[J]. Mol Immunol, 2015,67(1):3-11.
[15] Qi S, Chen Q, Xu D, et al. Clinical application of protein biomarkers in lupus erythematosus and lupus nephritis[J]. Lupus, 2018,27(10):1582-1590.
[16] Birmingham DJ, Irshaid F, Nagaraja HN, et al. The complex nature of serum C3 and C4 as biomarkers of lupus renal flare[J]. Lupus, 2010,19(11):1272-1280.
[17] Song D, Guo WY, Wang FM, et al. Complement alternative pathway?s activation in patients with lupus nephritis[J]. Am J Med Sci, 2017,353(3):247-257.
[18] Watanabe H, Noguchi E, Shio K, et al. Usefulness of complement split product, Bb, as a clinical marker for disease activity of lupus nephritis[J]. Fukushima J Med Sci, 2006,52(2):103-109.
[19] Bao L, Haas M, Quigg RJ. Complement factor H deficiency accelerates development of lupus nephritis[J]. J Am Soc Nephrol, 2011,22(2):285-295.
[20] Wang FM, Yu F, Tan Y, et al. Serum complement factor H is associated with clinical and pathological activities of patients with lupus nephritis[J]. Rheumatology (Oxford), 2012,51(12):2269-2277.
[21] Wang FM, Song D, Pang Y, et al. The dysfunctions of complement factor H in lupus nephritis[J]. Lupus, 2016,25(12):1328-1340.
[22] Marinozzi MC, Roumenina LT, Chauvet S, et al. Anti-factor B and anti-C3b autoantibodies in C3 glomerulopathy and ig-associated membranoproliferative GN[J]. J Am Soc Nephrol, 2017,28(5):1603-1613.
[23] Birmingham DJ, Bitter JE, Ndukwe EG, et al. Relationship of circulating anti-C3b and anti-C1q IgG to lupus nephritis and its flare[J]. Clin J Am Soc Nephrol, 2016,11(1):47-53.
[24] Yuan M, Tan Y, Pang Y, et al. Anti-pentraxin 3 auto-antibodies might be protective in lupus nephritis: a large cohort study[J]. Ren Fail, 2017,39(1):465-473.
[25] Bassi N, Del Prete D, Ghirardello A, et al. PTX3, anti-PTX3, and anti-C1q autoantibodies in lupus glomerulonephritis[J]. Clin Rev Allergy Immunol, 2015,49(2):217-226.
[26] Augusto JF, Poli C, Beauvillain C, et al. Anti-pentraxin antibodies in autoimmune systemic diseases: Focus on anti-pentraxin-3 autoantibodies[J]. Int Rev Immunol, 2017,36(3):145-153.
[27] Hirohata S, Kasama T, Kawahito Y, et al. Efficacy of anti-ribosomal P protein antibody testing for diagnosis of systemic lupus erythematosus[J]. Mod Rheumatol, 2014,24(6):939-944.
[28] Nalakonda G, Islam M, Chukwu VE, et al. Psycho-rheumatic integration in systemic lupus erythematosus: an insight into antibodies causing neuropsychiatric changes[J]. Cureus, 2018,10(8):e3091.
[29] Jeltsch-David H, Muller S. Neuropsychiatric systemic lupus erythematosus: pathogenesis and biomarkers[J]. Nat Rev Neurol, 2014,10(10):579-596.
[30] Karassa FB, Afeltra A, Ambrozic A, et al. Accuracy of anti-ribosomal P protein antibody testing for the diagnosis of neuropsychiatric systemic lupus erythematosus: an international meta-analysis[J]. Arthritis Rheum, 2006,54(1):312-324.
[31] Ogawa E, Nagai T, Sakuma Y, et al. Association of antibodies to the NR1 subunit of N-methyl-D-aspartate receptors with neuropsychiatric systemic lupus erythematosus[J]. Mod Rheumatol, 2016,26(3):377-383.
[32] Yang Y, Yuan C, Shen SQ, et al. Autoantibodies to NR2A peptide of the glutamate/NMDA receptor in patients with seizure disorders in neuropsychiatric systemic lupus erythematosus[J]. Mediators Inflamm, 2017,2017:5047898.
[33] Tay SH, Fairhurst AM, Mak A. Clinical utility of circulating anti-N-methyl-d-aspartate receptor subunits NR2A/B antibody for the diagnosis of neuropsychiatric syndromes in systemic lupus erythematosus and Sj?gren′s syndrome: An updated meta-analysis[J]. Autoimmun Rev, 2017,16(2):114-122.
[34] Gr?nwall C, Reynolds H, Kim JK, et al. Relation of carotid plaque with natural IgM antibodies in patients with systemic lupus erythematosus[J]. Clin Immunol, 2014,153(1):1-7.
[35] López P, Rodríguez-Carrio J, Martínez-Zapico A, et al. IgM anti-phosphorylcholine antibodies associate with senescent and IL-17+T cells in SLE patients with a pro-inflammatory lipid profile[J]. Rheumatology (Oxford), 2020,59(2):407-417.
[36] Vlachoyiannopoulos PG, Routsias JG. A novel mechanism of thrombosis in antiphospholipid antibody syndrome[J]. J Autoimmun, 2010,35(3):248-255.
[37] Iwaniec T, Kaczor MP, Celińska-L?wenhoff M, et al. Clinical utility of automated chemiluminescent antiphospholipid antibody assay[J]. Thromb Res, 2015,136(5):1033-1039.
[38] Zamora-Medina M, Hinojosa-Azaola A, Nu?ez-Alvarez CA, et al. Anti-RNP/Sm antibodies in patients with systemic lupus erythematosus and its role in thrombosis: a case-control study[J]. Clin Rheumatol, 2019,38(3):885-893.
[39] Hinojosa-Azaola A, Romero-Diaz J, Vargas-Ruiz AG, et al. Venous and arterial thrombotic events in systemic lupus erythematosus[J]. J Rheumatol, 2016,43(3):576-586.
