新生儿呼吸窘迫综合征超声诊断与分度多中心前瞻性研究
2020年11月
中华神经科杂志,第27卷第11期 第801页-第807页
刘敬,李洁,单瑞艳,邓碧滢,王英俊,黄荔涵,宗海峰,徐彦磊,孟琼,刘艳,曹海燕,管亚丽,于霞,涂昊,刘女霞,游楚明,袁丽,张丽,刘燕妮,邱如新
迄今,呼吸窘迫综合征(respiratory distress syndrome,RDS)仍是新生儿呼吸困难和导致其死亡的常见原因之一。据统计,在不发达国家,RDS发生率占活产儿总数的1.72%~8.20%,其中早产儿为23.8%~37.30%、足月儿为0.11%[1,2];胎龄越小发生率越高,如胎龄≤ 26周为100%,~32周为57.1%,~36周为3.7%[1]。美国的调查发现RDS在胎龄≤ 34周的早产儿发生率为26%[3]。在NICU住院患儿中,足月儿RDS占1.64%~3.8%[4,5,6]。RDS也是新生儿气胸、肺出血和新生儿持续性肺动脉高压(persistent pulmonary hypertension of the newborn,PPHN)等的常见原因[7,8,9],并发症增加了RDS的病死率,甚至高达43.6%[1]。早期正确诊断和规范化治疗是改善其预后的关键。长期以来,依据典型病史、临床表现、动脉血气分析和胸部X线检查等诊断RDS存在误诊率[10,11]。近年来,肺脏超声(lung ultrasound,LUS)已经成功用于新生儿肺脏疾病的诊断和鉴别诊断,并形成了多项指南性文件[12,13,14,15]。此前,国内外对用LUS诊断RDS虽已有较多研究报道,但均系单中心经验[16,17,18,19,20]。虽然在开展较好的单位,LUS已经彻底替代X线检查常规用于新生儿肺疾病的诊断和鉴别诊断[21],然而更多的单位尚没有开展或处于摸索阶段。因此,有必要开展多中心研究以验证LUS诊断RDS的可行性和常规应用的必要性。
此外,长期临床实践发现,虽然多数医师对典型RDS的LUS诊断很成熟,但对早期或轻度RDS的诊断尚存在困难,对重度RDS的认识也存在明显不足,从而导致病情发展、治疗延误,甚至预后不良。因此,有必要在研究RDS超声诊断价值的基础上,研究其分度并明确不同程度RDS的超声影像学特点,从而更加有助于对RDS的正确管理。为此,自2018年起我们组织了多中心、前瞻性研究,旨在探讨对RDS进行超声分度的必要性及不同程度RDS的超声影像学特点。
所有参与单位均参加过全国新生儿LUS培训班,并在全国新生儿LUS培训基地接受为期3~6个月的LUS系统培训,以确保研究结果的准确性和可靠性。纳入标准:参与单位中患儿病史、临床表现和动脉血气分析等提示RDS可能,且LUS检查符合RDS诊断标准[12,14,22]、图谱质量合格、资料完整的病例。排除标准:LUS图谱质量不合格、病例资料不完整的单位或病例;合并复杂先天性心脏病、染色体异常等可能影响研究结果的病例。本研究通过北京市朝阳区妇幼保健院伦理委员会批准(批号:CYFY-2019-E0108)。在研究期间(2018年6月至2020年5月)共有19家单位参与,其中4家单位因超声图谱质量不合格、资料不符合要求而未被纳入,最终纳入15家单位。15家单位在研究期间共收集病例352例,其中77例不合格病例被剔除,本研究对其中275例合格病例进行归纳、总结和分析。
本研究使用仪器主要为GE Voluson S10 (美国,通用电气)和PHILIPS EPIQ5 (荷兰,PHILIPS)超声诊断仪。LUS检查方法及RDS的超声诊断标准依据有关指南[12,14,22]。患儿入院后即刻完成LUS检查,对12个肺脏分区(即以腋前线、腋后线为界将肺脏分成前、侧、后3个区域,即两侧肺脏被分为6个区域;再以两乳头连线为界,将每侧肺脏分成上、下2个肺野,从而将双侧肺脏分成12个区域)[12,14]进行全面扫查、记录检查发现并保留图谱,根据病情需要随时动态复查。除传统超声指标外[12,14] ,本研究主要超声征象包括:(1)磨玻璃征(ground-glass opacity sign):即在超声下近场回声较强、由浅入深回声逐渐减弱、类似磨玻璃样表现但支气管充气征尚不明显的轻度肺实变,探头沿着肋间隙平行扫描更易于显示这种轻微病变;(2)雪花征(snowflake sign):肺实变区域内密集存在的斑片状、点状或细线样支气管充气征,在超声影像上表现为类似雪花样的征象[23]。此外,为便于比较,部分患儿同时接受了胸部X线检查。
在完成LUS检查前或后立即完成动脉血气分析以尽可能保持LUS检查结果与血气分析的可比性;并依LUS检查所见肺部病变程度不同为标准进行分组,比较各组间血气分析的差异。
使用SPSS 21.0软件对各组患儿的胎龄、出生体重、发病时间、入院时间和入院时动脉血气分析结果进行统计学分析,计量资料采用均数±标准差(Mean±SD)表示,计数资料以例(%)表示。首先进行方差齐性检验,然后进行方差分析(方差齐性)或秩和检验(方差不齐),P<0.05为差异有统计学意义。
在275例患儿中,男174例、女101例。自然分娩96例,剖宫产179例。早产儿220例,胎龄(31.90±2.82)周(24+2~36+6周);出生体重(1 821.0±624.6)g,范围(560~3 970 g)。足月儿55例,胎龄(38.20±1.16)周(37~40+5周);出生体重(3 092.0±427.2)g(2 090~3 900 g)。存在胎膜早破128例,宫内感染97例,重度宫内窘迫和(或)出生时重度窒息31例,羊水胎粪Ⅲ°污染21例。依据病史、临床表现和实验室检查,没有发现明确诱因者诊断为原发性RDS 117例(42.5%),存在明确诱因者诊断为继发性RDS 158例(57.5%)。
50例患儿入院时即首次LUS即表现为磨玻璃征(
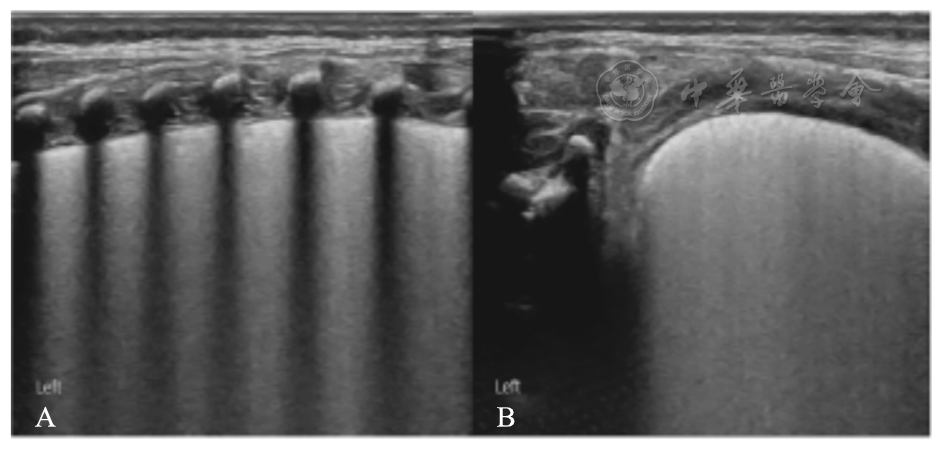
患儿,女,胎龄30+1周,剖宫产娩出,出生体重1 570 g。出生时无窒息,生后20 min发生呼吸困难进行性加重。入院时动脉血气分析:pH 7.255,PaCO2 52.8 mmHg(1 mmHg=0.133 kPa),PaO2 48.7 mmHg,SaO2 88%。LUS:探头与肋骨垂直扫描(A)显示胸膜线增粗模糊、近场回声增强、远场回声明显减弱,呈磨玻璃征样改变;当探头沿肋间隙平行扫描时(B),近场磨玻璃征样表现更为明显。
204例患儿入院时(即首次)LUS表现为雪花征样肺实变,分别累及1~2个肋间隙至全部肺脏分区不等(
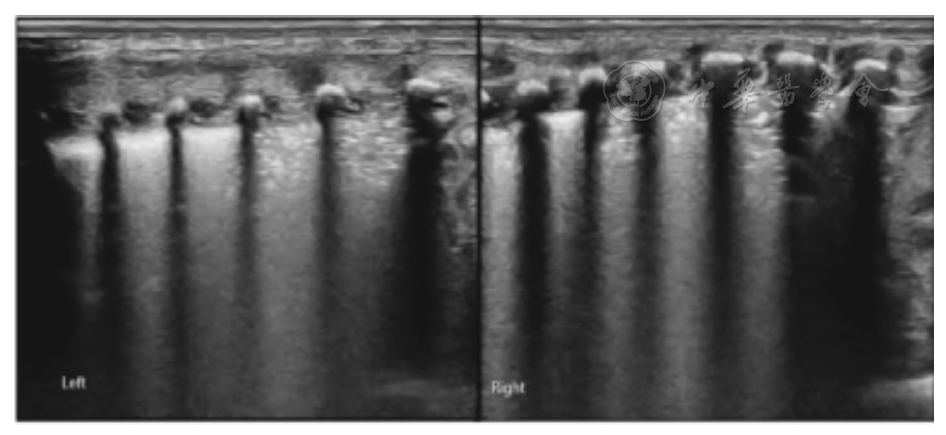
患儿,女,G1P2,胎龄36周,出生体重2 230 g。生后30 min出现呼吸困难进行性加重。动脉血气分析:PaCO2 42.4 mmHg,PaO2 26.3 mmHg,SaO2 65.3%。LUS显示双肺均见雪花征样肺实变累及部分肋间隙。
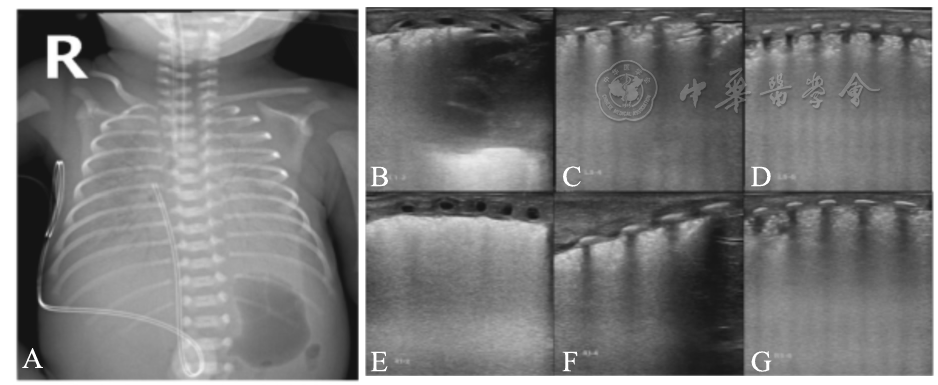
患儿,男,G1P1,胎龄26+4周,试管婴儿,胎盘早剥,出生体重980 g。生后即出现呼吸困难。FiO2 0.5情况下,动脉血气分析:PaCO2 90 mmHg,PaO2 30 mmHg。胸部X线呈"白肺"样改变(A),LUS双肺均呈典型雪花征样肺实变,并累及所有肺分区(B、C、D:左肺,E、F、G:右肺)。
21例患儿在入院时虽然肺实变没有累及全部肺野,但已经发生了严重肺部并发症,包括气胸9例、肺出血3例(
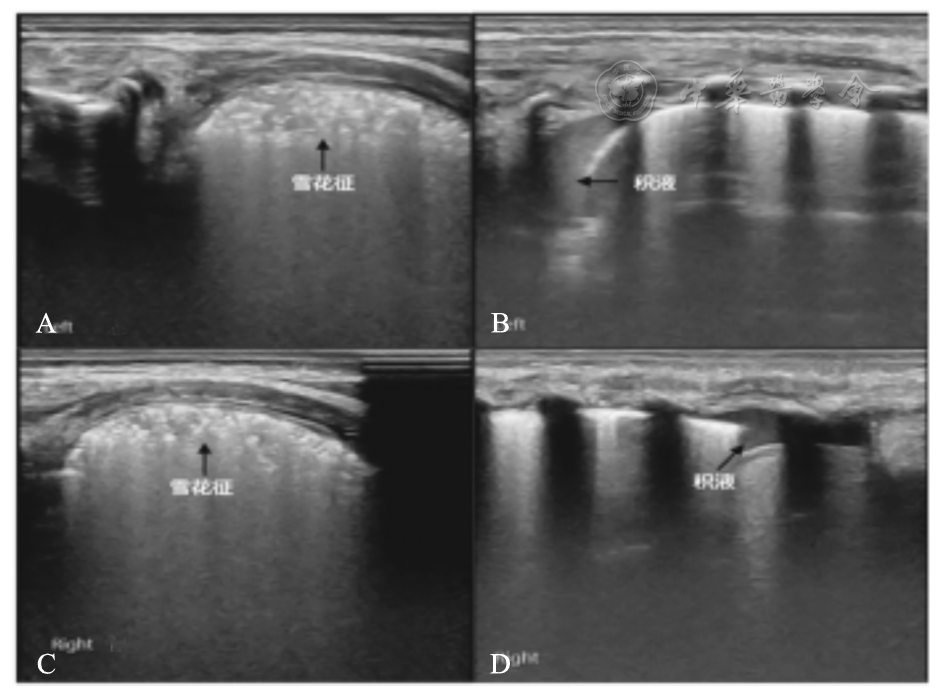
患儿,男,胎龄38+3周,自然分娩,出生体重3 590 g。生后3 h出现进行性呼吸困难,在呼吸机辅助通气下于生后6 h转入。动脉血气分析:PaCO2 46.1 mmHg,PaO2 51 mmHg,SaO2 91%。LUS显示双肺均有部分肋间呈典型雪花征样肺实变伴双侧少许胸腔积液[左肺肺尖处(A、B)及右肺肺底处(C、D)],同时气管插管内吸出少量鲜红色液体,证实为RDS并发肺出血。
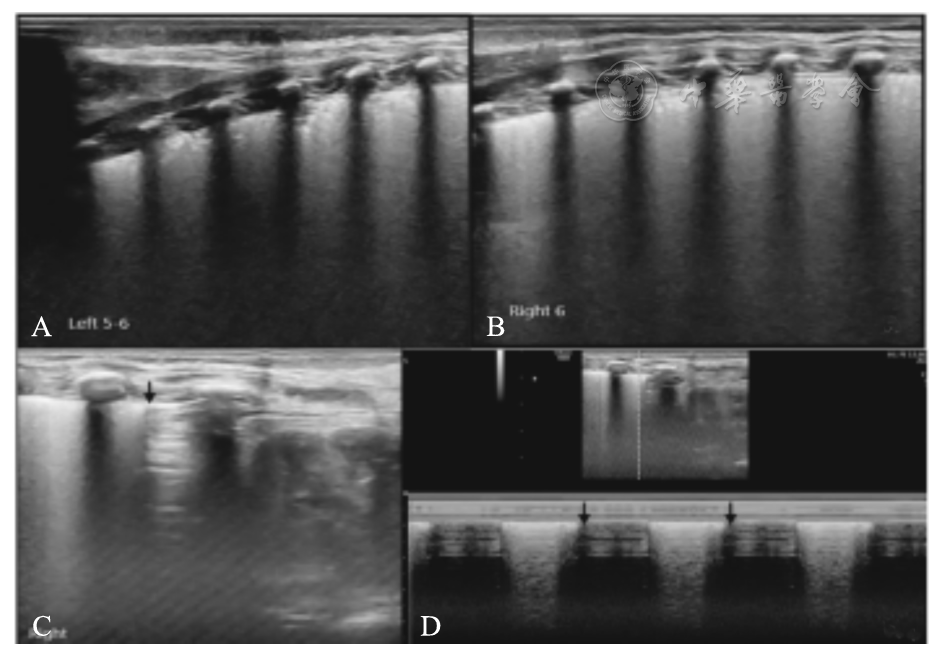
患儿,男,系G4P2,胎龄38周,剖宫产娩出,出生体重3 870 g。生后3 h出现呼吸困难、进行性加重。动脉血气分析:PaCO2 43 mmHg,PaO2 27 mmHg,SaO2 66%。LUS显示双肺均见明显雪花征样肺实变(A、B),同时右肺背部下野靠近肺底处,在B型超声和M型超声下均可见肺点(C、D箭头所示),证实为轻度气胸。同时超声心动图证实存在PPHN,给予高频通气+NO吸入治疗。
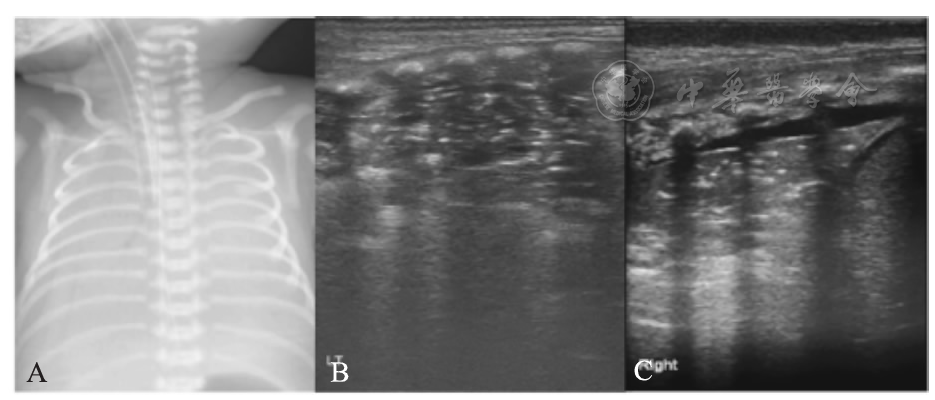
患儿,男,G1P1,胎龄27周,出生体重1 050 g。生后即出现呼吸困难进行性加重,于生后3 h入院。机械通气下,动脉血气分析PaCO2 67 mmHg,PaO2 31 mmHg,SaO2 73%。外院X线近似"白肺"样表现(A)。LUS显示(B、C)双肺实变伴支气管充气征,右下肺尤为严重,呈肺不张样改变(C)。
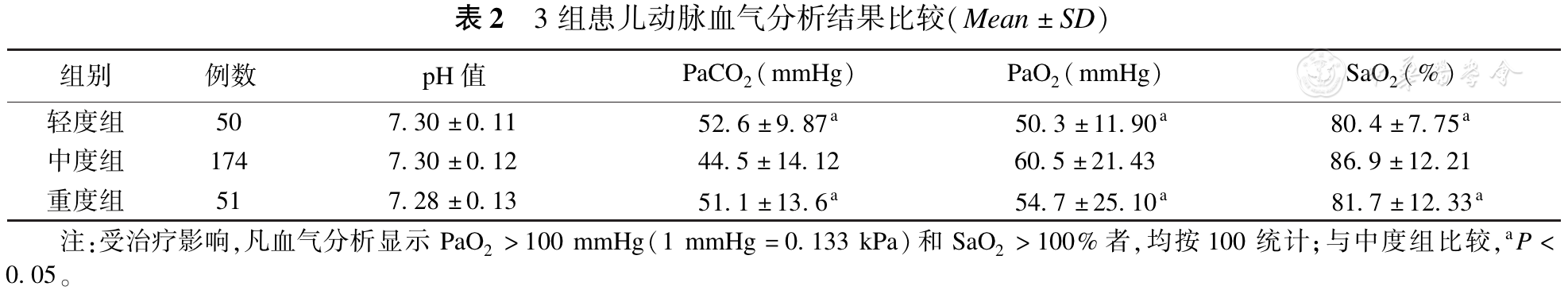
根据LUS检查所见肺部病变程度,将患儿分为3组,即轻度组(LUS表现为磨玻璃征,50例)、中度组(LUS表现为雪花征但未累及全部肺分区且无并发症,174例)、重度组(LUS表现为雪花征累及全部肺分区30例+发生并发症21例)。3组患儿的性别构成、胎龄、出生体重、发病时间及入院时间差异均无统计学意义(P>0.05)(

本组患儿死亡4例,总体病死率1.45%,其余患儿预后良好。
本多中心研究结果表明,在培训合格后,使用LUS可对RDS做出准确诊断。我们的长期临床实践、来自文献和循证医学的证据均表明,LUS诊断RDS的准确性和可靠性高,敏感性和特异性分别达到99%和95%以上[24,25,26,27]。
本研究275例RDS患儿中,早产儿220例、足月儿55例;原发性RDS 117例(42.5%)、继发性RDS 158例(57.5%)。他们均具有相同的超声表现,轻度(即早期)表现为磨玻璃征样肺实变,病情进展则呈雪花征样肺实变,进一步发展可表现为更为严重的肝样肺实变或肺不张。
本组50例患儿在入院时(即首次)LUS表现为磨玻璃征样肺实变。因经验不足,其中28例被误认为湿肺而未予特殊处置,但病情很快进展,在0.5~4 h内发展至雪花征样肺实变。而另外22例给予机械通气和补充外源性肺表面活性物质治疗者,18例病情在6~12 h内控制,仅4例因严重宫内感染所致者病变进一步发展。可见,加强对RDS早期超声征象识别的重要性。之所以容易误诊为肺水肿,是因其与融合B线不易区别。B线是起源于胸膜线并与之垂直,呈放射状发散至肺野深部并直达扫描屏幕边缘的线形高回声,其最大特点是从肺野浅部至深部回声不减弱,据此可与磨玻璃征区别。
除上述50例患儿外,本研究275例患儿中的其余225例(81.8%)患儿均表现为不同程度的雪花征,可仅累及1~2个肋间隙,甚至所有肺野(即12个肺分区),提示雪花征是RDS最具特征性的超声改变[28]。但是,雪花征并不是RDS最早期的LUS改变,而是病情发展至一定阶段或一定程度后的表现。如当病情发展至此阶段才开始治疗,则已延误了部分患儿的病情,甚至继续恶化。因此,有必要在更早阶段对其作出明确诊断,并阻止病情进展,这也说明了对RDS进行超声分度的必要性。
重症RDS常导致各种严重并发症,本组患儿中发生气胸9例,肺出血3例,肺出血+气胸1例,PPHN 1例,PPHN+气胸1例,大面积肺不张6例,共计21例(7.64%)。气胸是其最常见并发症,均已除外呼吸机使用不当等因素所致者,与RDS时肺内各部位病变程度不一致有关。当这些并发症发生后,RDS患儿的病死率将显著增加[7,8,9]。LUS对早期发现上述并发症并予以正确处置有重要指导价值,有助于改善患儿预后[29,30]。
理论上疾病程度越重、动脉血气分析结果异常的程度亦应越严重。但根据本研究结果可知,由于疾病较重(中度组)的患儿在入院前或转诊过程中已经接受氧疗,甚至呼吸机治疗使血气分析异常程度并不严重;反而轻症患儿(轻度组)由于没有接受氧疗,动脉血气分析结果反而呈现明显异常,导致动脉血气分析结果不能客观反映疾病程度;然而更为严重的患儿(重度组)虽然接受了治疗,但由于病情过于严重而使其血气分析值难以纠正(
由上述可知,为早期RDS的正确管理和改善重度RDS的预后,有必要对RDS进行超声分度。由于动脉血气分析和胸部X线不能作为RDS分度的依据,根据本研究结果和文献证据[24,25,26,27],对RDS进行超声分度具有科学性和合理性。本研究认为根据RDS的超声表现及是否导致了严重并发症,将其分成轻、中、重三度具有实用性和可行性。具体标准如下:轻度:即RDS早期,肺实变在超声影像上表现为磨玻璃征,累及范围不限;中度:肺实变在超声影像上表现为雪花征,且尚没有累及全部肺野;重度:具备以下任何一项或以上者:(1)肺实变在超声影像上表现为雪花征,但已累及所有肺分区;(2)肺实变程度和范围不限,但已引起气胸、和(或)肺出血、和(或)PPHN、和(或)大面积肺不张(至少累及1个肺分区)等严重并发症。据此超声分度,本组21例患儿发生了严重并发症,故重度患儿并发症的发生率为41.2%(21/51);同样,死亡4例亦均为重度患儿,故本组重度RDS的病死率为7.84%(4/51)。
总之,通过该多中心、前瞻性研究,结合我们在LUS领域长达10年的应用经验[30],为加强对RDS的优质管理,避免不合理治疗或过度治疗,加强对重度患儿的合理管理,彻底改善其预后,我们认为有必要常规使用LUS对RDS进行诊断和分度。本研究结果还表明,不同程度RDS间性别构成、胎龄与出生体重等均无差异,患儿发病时间无差异,发病均较早。因此,无论早产儿或足月儿,对以呼吸困难为主诉入院者,均应及早实施LUS检查,以明确或除外RDS可能。
本研究的局限性在于各单位使用的超声仪器型号不完全统一,可能影响图像质量及对结果的判读;不同仪器的微调模式不同,有待于今后进一步完善;分度方法的准确性、实用性、可行性及对临床指导价值,仍需在今后的应用中加以验证和完善。
[1] Ghafoor T, Mahmud S, Ali S,et al.Incidence of respiratory distress syndrome[J].J Coll Physicians Surg Pak,2003,13(5):271.
[2] Jaberi E, Roksana M.A study on preterm births during 2013-2015,Shiraz, Iran[J].J Obstet Gynaecol,2018,38(1):22-26.
[3] Donda K, Vijayakanthi N, Dapaah-Siakwan F,et al.Trends in epidemiology and outcomes of respiratory distress syndrome in the United States[J].Pediatr Pulmonol,2019,54(4):405-414.
[4] Alfarwati TW, Alamri AA, Alshahrani MA,et al.Incidence,Risk factors and Outcome of Respiratory Distress Syndrome in Term Infants at Academic Centre,Jeddah,Saudi Arabia[J].Med Arch,2019,73(3):183-186.
[5] Liu J, Shi Y, Dong JY,et al.Clinical characteristics,diagnosis and management of respiratory distress syndrome in full-term neonates[J].Chin Med J (Engl),2010,123(19):2640-2644.
[6] 刘敬,王晓凤,王华伟,等.足月新生儿呼吸窘迫综合征的诊断与治疗研究[J].中华全科医师杂志,2013,12(12):993-995.
[7] Lee M, Wu K, Yu A,et al.Pulmonary hemorrhage in neonatal respiratory distress syndrome:Radiographic evolution,course,complications and long-term clinical outcomes[J].J Neonatal Perinatal Med,2019,12(2):161-171.
[8] Vibede L, Vibede E, Bendtsen M,et al.Neonatal Pneumothorax:A Descriptive Regional Danish Study[J].Neonatology,2017,111(4):303-308.
[9] Razzaq A, Iqbal Quddusi A, Nizami N,et al.Risk factors and mortality among newborns with persistent pulmonary hypertension[J].Pak J Med Sci,2013,29(5):1099-1104.
[10] Brice JE, Walker CH.Changing pattern of respiratory distress in newborn[J].Lancet,1977,2(8041):752-754.
[11] Rocha G, Rodrigues M, Guimar?es H.Respiratory distress syndrome of the preterm neonate-placenta and necropsy as witnesses[J].J Matern Fetal Neonatal Med,2011,24(1):148-151.
[12] 中华医学会儿科学分会围产医学专业委员会,中国医师协会新生儿科医师分会超声专业委员会,中国医药教育协会超声医学专业委员会重症超声学组,等.新生儿肺脏疾病超声诊断指南[J].中华实用儿科临床杂志,2018,33(4):1057-1064.
[13] 中国医药教育协会超声医学专业委员会重症超声学组.感染性肺炎超声诊断专家建议[J].中华医学超声杂志(电子版),2020,17(3):244-250.
[14] Liu J, Copetti R, Sorantin E,et al.Protocol and Guidelines for Point-of-Care Lung Ultrasound in Diagnosing Neonatal Pulmonary Diseases Based on International Expert Consensus[J].J Vis Exp,2019:145.
[15] Liu J, Kurepa D, Feletti F,et al.International Expert Consensus and Recommendations for Neonatal Pneumothorax Ultrasound Diagnosis and Ultrasound-guided Thoracentesis Procedure[J].J Vis Exp,2020:157.
[16] Copetti R, Cattarossi L, Macagno F,et al.Lung ultrasound in respiratory distress syndrome:a useful tool for early diagnosis[J].Neonatology,2008,94(1):52-59.
[17] 刘敬,曹海英,刘颖.肺脏超声对新生儿呼吸窘迫综合症的诊断价值[J].中华儿科杂志,2013,51(3):205-210.
[18] Liu J, Cao HY, Wang HW,et al.The role of lung ultrasound in diagnosis of respiratory distress syndrome in newborn infants[J].Iran J Pediatr,2014,24(2):147-154.
[19] Oktem A, Yigit S, Oguz B,et al.Accuracy of lung ultrasonography in the diagnosis of respiratory distress syndrome in newborns[J].J Matern Fetal Neonatal Med,2019[
[20] Grimaldi C, Michel F, Brévaut-Malaty V,et al.Thoracic ultrasound accuracy for the investigation of initial neonatal respiratory distress[J].Arch Pediatr,2019,26(8):459-465.
[21] 高月乔,邱如新,刘敬,等.新生儿病房内超声替代X线检查诊断肺疾病二年临床实践[J].中国小儿急救医学,2019,26(8):588-590.
[22] 刘敬.肺脏超声诊断新生儿呼吸窘迫综合征[J].中华实用儿科临床杂志,2014,29(18):1438-1440.
[23] Liu J, Qiu RX, Ren XL.The Ultrasonic Imaging Characteristics of Neonatal Respiratory Distress Syndrome (RDS):the New Concept of Lung Ultrasound to Diagnose RDS[J].Chest,2020,157(S6):A318.
[24] Liu J, Cao HY, Wang XL,et al.The significance and the necessity of routinely performing lung ultrasound in the neonatal intensive care units[J].J Matern Fetal Neonatal Med,2016,29(24):4025-4030.
[25] Liu J, Lovrenski J, Hlaing AY,et al.Neonatal lung diseases:lung ultrasound or chest x-ray[J].J Matern Fetal Neonatal Med,2019:1-6.
[26] Hiles M, Culpan AM, Watts C,et al.Neonatal respiratory distress syndrome:Chest X-ray or lung ultrasound?A systematic review[J].Ultrasound,2017,25(2):80-91.
[27] Ma H, Yan W, Liu J,et al.Diagnostic value of lung ultrasound for neonatal respiratory distress syndrome:a meta-analysis and systematic review[J].Med Ultrason,2020,22(3):325-333.
[28] 邱如新,郭九叶,刘敬.超声监测在新生儿肺疾病治疗中的应用[J].中华实用儿科临床杂志,2019,34(1):13-18.
[29] Liu J, Xia RM, Ren XL,et al.The new application of point-of-care lung ultrasound in guiding or assisting neonatal severe lung disease treatment based on a case series[J].J Matern Fetal Neonatal Med,2020,33(23):3907-3915.
[30] 刘敬.中国儿童肺脏超声医学回顾与展望[J].中国实用儿科杂志,2019,34(9):753-756.
