中国2型糖尿病防治指南(2020年版)
中华糖尿病杂志,第13卷第4期 第315页-第409页

1.我国糖尿病患病率仍在上升,2015至2017年达到11.2%,各民族有较大差异,各地区之间也存在差异。
2.糖尿病的知晓率(36.5%)、治疗率(32.2%)和控制率(49.2%)有所改善,但仍处于低水平。
3.糖尿病人群中T2DM占90%以上。
近30多年来,我国糖尿病患病率显著增加。1980年全国14省市30万人的流行病学资料显示,糖尿病的患病率为0.67%[1]。1994至1995年全国19省市21万人的流行病学调查显示,25~64岁人群糖尿病患病率为2.51%,糖耐量减低(IGT)患病率为3.20%[2]。2002年中国居民营养与健康状况调查以空腹血糖≥5.5 mmol/L作为筛选指标,高于此水平的人群进行口服葡萄糖耐量试验(OGTT),结果显示在18岁以上的人群中,城市人口的糖尿病患病率为4.5%,农村人口为1.8%[3]。2007至2008年,中华医学会糖尿病学分会组织的全国14个省市糖尿病流行病学调查结果显示,我国20岁及以上成年人的糖尿病患病率为9.7%[4]。2010年中国疾病预防控制中心和中华医学会内分泌学分会调查了中国18岁及以上人群糖尿病的患病情况,显示糖尿病患病率为9.7%[5]。2013年我国慢性病及其危险因素监测结果显示,18岁及以上人群糖尿病患病率为10.4%[6]。2015至2017年中华医学会内分泌学分会在全国31个省进行的甲状腺、碘营养状态和糖尿病的流行病学调查显示,我国18岁及以上人群糖尿病患病率为11.2%[7](
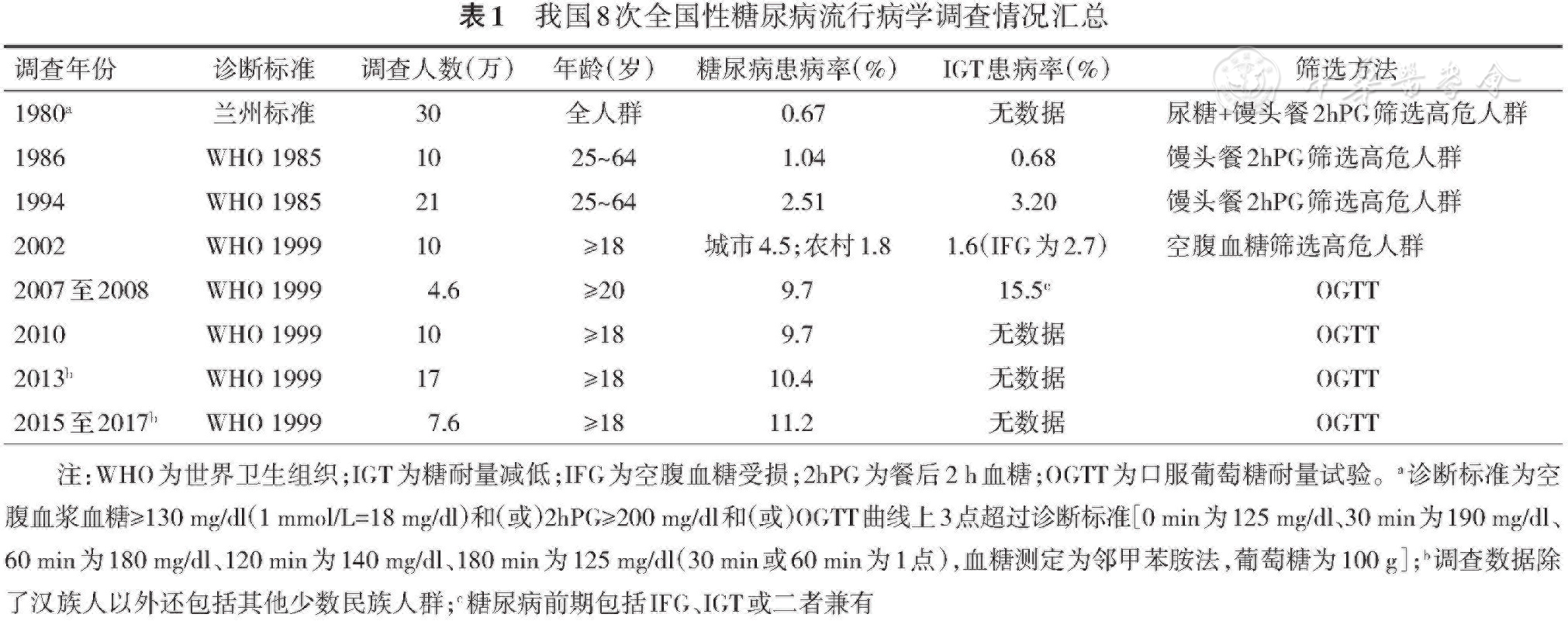
1.以2型糖尿病(T2DM)为主,1型糖尿病(T1DM)和其他类型糖尿病少见,男性高于女性(2015至2017年全国调查结果为12.1%和10.3%)[7]。中国研究课题组2010至2013年在全国13个地区进行了T1DM流行病学研究,覆盖了全年龄段T1DM和10%的全国总人口,结果显示全年龄段T1DM发病率为1.01/10万人年。在新发T1DM患者中,20岁以上患者占65.3%[8]。在2015至2017年全国46家三级医院招募的30岁及以上的17 349例新诊断糖尿病患者中,T1DM(经典T1DM和成人隐匿型自身免疫性糖尿病)占5.8%,非T1DM(T2DM和其他特殊类型糖尿病)占94.2%[9]。糖尿病人群中T2DM占90%以上。
2.各民族的糖尿病患病率存在较大差异。2013年的调查结果显示,我国6个主要民族的糖尿病患病率分别为汉族14.7%、壮族12.0%、回族10.6%、满族15.0%、维吾尔族12.2%、藏族4.3%[6]。
3.我国经济发达地区的糖尿病患病率高于中等发达地区和不发达地区[4, 5, 6]。城市高于农村,在不发达地区和中等发达地区这一差别尤为明显[4, 5, 6],2015至2017年的调查结果显示城乡差别有减小的趋势[7]。
4.未诊断的糖尿病比例较高。2013年全国调查结果显示,新诊断的糖尿病患者占总糖尿病人数的62%[6],2015至2017年调查结果显示这一比例为54%,较前有所下降。从2010、2013年两次大规模流行病学调查结果看,按照美国糖尿病学会(ADA)标准诊断的糖尿病患者中,糖尿病的知晓率分别为30.1%和36.5%,治疗率分别为25.8%和32.2%,控制率分别为39.7%和49.2%,都有所改善,但仍处于较低水平,尤其在农村更明显[5, 6, 7]。
5.肥胖和超重人群糖尿病患病率显著增加。2010、2013、2015至2017年的调查结果显示,体重指数(BMI)<25 kg/m2者糖尿病患病率分别为6.9%、7.4%和8.8%,25 kg/m2≤BMI<30 kg/m2者糖尿病患病率分别为14.3%、14.7%和13.8%,BMI≥30 kg/m2者糖尿病患病率分别为19.6%、19.6%和20.1%[5, 6, 7]。
1.城市化:随着经济的发展,中国的城市化进程明显加快。中国城镇人口占全国人口比率在2000年为36.09%[10],2008年为45.7%,2017年达到58.5%[11, 12]。
2.老龄化:中国60岁以上老年人的占比逐年增加,2000年为10%,2008年为12%,2017年增加到17.3%[10, 11, 12]。2007至2008、2010、2013、2015至2017年的调查中,60岁以上的老年人群糖尿病患病率均接近或超过20%[4, 5, 6, 7]。
3.超重和肥胖患病率增加:中国居民营养与慢性病状况报告(2015年)显示,超重率和肥胖率呈上升趋势,全国18岁及以上成人超重率为30.1%,肥胖率为11.9%,比2002年分别上升了7.3%和4.8%;6~17岁儿童、青少年超重率为9.6%,肥胖率为6.4%,比2002年分别上升了5.1%和4.3%[13]。2010年的调查结果显示,BMI≥30 kg/m2者占比为5.7%,2015至2017年调查时BMI≥30 kg/m2者占比为6.3%,平均腰围从80.7 cm增加到83.2 cm[5, 7]。
4.中国人T2DM的遗传易感性:T2DM的遗传易感性存在种族差异。与高加索人相比,在调整性别、年龄和BMI后,亚裔人群糖尿病的患病风险增加60%。在发达国家及地区居住的华人糖尿病的患病率显著高于高加索人[6]。目前全球已经定位超过100个T2DM易感位点,包括KCNJ11、PPARG、KCNQ1等,但高加索人发现的易感基因中不到50%在中国人群中能得到验证。在中国人中还发现了PAX4、NOS1AP等T2DM易感基因[14, 15, 16, 17, 18]。与中国人T2DM显著相关的40个易感位点构建的遗传评分模型可用于预测中国人T2DM的发生,并揭示遗传易感性主要与胰岛β细胞功能减退有关[19]。
1.空腹血糖、随机血糖或OGTT 2 h血糖是诊断糖尿病的主要依据,没有糖尿病典型临床症状时必须重复检测以确认诊断。(A)
2.在有严格质量控制的实验室,采用标准化检测方法测定的HbA1c可以作为糖尿病的补充诊断标准。(B)
3.按病因将糖尿病分为T1DM、T2DM、特殊类型糖尿病和妊娠期糖尿病4种类型。(A)
依据静脉血浆葡萄糖而不是毛细血管血糖测定结果诊断糖尿病。若无特殊提示,本章所提到的血糖均为静脉血浆葡萄糖值。糖代谢状态分类标准和糖尿病诊断标准见


2011年世界卫生组织(WHO)建议在条件具备的国家和地区采用糖化血红蛋白(HbA1c)诊断糖尿病,诊断切点为HbA1c≥6.5%[22]。我国从2010年开始进行“中国HbA1c教育计划”,随后国家食品药品监督管理局发布了糖化血红蛋白分析仪的行业标准,国家卫生和计划生育委员会临床检验中心发布了《糖化血红蛋白实验室检测指南》,并实行了国家临床检验中心组织的室间质量评价计划,我国的HbA1c检测标准化程度逐步提高。国内一些横断面研究结果显示,在中国成人中HbA1c诊断糖尿病的最佳切点为6.2%~6.5%。为了与WHO诊断标准接轨,推荐在采用标准化检测方法且有严格质量控制(美国国家糖化血红蛋白标准化计划、中国糖化血红蛋白一致性研究计划)的医疗机构,可以将HbA1c≥6.5%作为糖尿病的补充诊断标准。但是,在以下情况下只能根据静脉血浆葡萄糖水平诊断糖尿病:镰状细胞病、妊娠(中、晚期)、葡萄糖-6-磷酸脱氢酶缺乏症、艾滋病、血液透析、近期失血或输血、促红细胞生成素治疗等。此外,不推荐采用HbA1c筛查囊性纤维化相关糖尿病[23]。
空腹血浆葡萄糖、75 g口服葡萄糖耐量试验(OGTT)后的2 h血浆葡萄糖值或HbA1c可单独用于流行病学调查或人群筛查。如OGTT的目的仅在于明确糖代谢状态时,仅需检测空腹和糖负荷后2 h血糖。我国的流行病学资料显示,仅查空腹血糖,糖尿病的漏诊率较高,理想的调查是同时检测空腹血糖、OGTT后的2 h血糖及HbA1c。OGTT其他时间点血糖不作为诊断标准。建议血糖水平已达到糖调节受损的人群,应行OGTT,以提高糖尿病的诊断率。
急性感染、创伤或其他应激情况下可出现暂时性血糖升高,不能以此时的血糖值诊断糖尿病,须在应激消除后复查,再确定糖代谢状态。在上述情况下检测HbA1c有助于鉴别应激性高血糖和糖尿病。
采用WHO(1999年)的糖尿病病因学分型体系,根据病因学证据将糖尿病分为4种类型,即1型糖尿病(T1DM)、2型糖尿病(T2DM)、特殊类型糖尿病和妊娠期糖尿病[20]。T1DM包括免疫介导型和特发性T1DM。特殊类型糖尿病包括如下几类:
1.胰岛β细胞功能单基因缺陷:葡萄糖激酶(GCK)基因突变[青少年的成人起病型糖尿病(MODY)2];肝细胞核因子-1α(HNF-1α)基因突变(MODY3);肝细胞核因子-4α(HNF-4α)基因突变(MODY1);肝细胞核因子-1β(HNF-1β)基因突变(MODY5);线粒体DNA 3243突变[母系遗传的糖尿病和耳聋(MIDD)];钾离子通道KCNJ11基因突变[永久性新生儿糖尿病(PNDM)];钾离子通道KCNJ11基因突变[发育迟缓癫痫和新生儿糖尿病(DEND)];染色体6q24印迹异常[暂时性新生儿糖尿病(TNDM)];ATP结合盒亚家族成员8(ABCC8)基因突变(MODY12);胰岛素(INS)基因突变(PNDM);WFS1基因突变(Wolfram综合征);FOXP3基因突变(IPEX综合征);EIF2AK3基因突变(Wolcott-Rallison综合征)。
2.胰岛素作用单基因缺陷:胰岛素受体基因突变(A型胰岛素抵抗、矮妖精貌综合征、Rabson-Mendenhall综合征);PPARG基因突变或LMNA基因突变(家族性部分脂肪营养不良);AGPAT2基因突变或BSCL2基因突变(先天性全身脂肪营养不良)。
3.胰源性糖尿病:纤维钙化性胰腺病、胰腺炎、创伤/胰腺切除术、胰腺肿瘤、囊性纤维化、血色病等。
4.内分泌疾病:库欣综合征、肢端肥大症、嗜铬细胞瘤、胰高糖素瘤、甲状腺功能亢进症、生长抑素瘤、原发性醛固酮增多症等。
5.药物或化学品所致糖尿病:糖皮质激素、某些抗肿瘤药、免疫检查点抑制剂[24]、α-干扰素等。
6.感染:先天性风疹、巨细胞病毒、腺病毒、流行性腮腺炎病毒等。
7.不常见的免疫介导性糖尿病:僵人综合征、胰岛素自身免疫综合征、胰岛素受体抗体等。
8.其他与糖尿病相关的遗传综合征:Down综合征、Friedreich共济失调、Huntington舞蹈病、Klinefelter综合征、Laurence-Moon-Beidel综合征、强直性肌营养不良、卟啉病、Prader-Willi综合征、Turner综合征等。
T1DM、T2DM和妊娠期糖尿病是临床常见类型。T1DM病因和发病机制尚未完全明了,其显著的病理学和病理生理学特征是胰岛β细胞数量显著减少乃至消失所导致的胰岛素分泌显著下降或缺失。T2DM的病因和发病机制目前亦不明确,其显著的病理生理学特征为胰岛素调控葡萄糖代谢能力的下降(胰岛素抵抗)伴胰岛β细胞功能缺陷所导致的胰岛素分泌减少(相对减少)。特殊类型糖尿病是病因学相对明确的糖尿病。随着对糖尿病发病机制研究的深入,特殊类型糖尿病的种类会逐渐增加。
1. T1DM和T2DM的主要鉴别点:不能仅依据血糖水平进行糖尿病的分型。即使是被视为T1DM典型特征的糖尿病酮症酸中毒在T2DM中也会出现。在糖尿病患病初期进行分型有时很困难。如果一时不能确定分型,可先做一个临时性分型,用于指导治疗。然后依据患者对治疗的初始反应以及追踪观察其临床表现再重新评估、分型。
目前诊断T1DM主要根据患者的临床特征。T1DM具有以下特点:年龄通常小于30岁;“三多一少”症状明显;常以酮症或酮症酸中毒起病;非肥胖体型;空腹或餐后的血清C肽浓度明显降低;出现胰岛自身免疫标记物,如谷氨酸脱羧酶抗体(GADA)、胰岛细胞抗体(ICA)、胰岛细胞抗原2抗体(IA-2A)、锌转运体8抗体(ZnT8A)等。
暴发性1型糖尿病是急性起病的T1DM,东亚人多见,主要临床特征包括起病急、高血糖症状出现时间非常短(通常不到1周)、诊断时几乎没有C肽分泌、诊断时存在酮症酸中毒、大多数胰岛相关自身抗体阴性、血清胰酶水平升高、疾病发作前有流感样症状和胃肠道症状。
在T1DM中,有一种缓慢进展的亚型,即成人隐匿性自身免疫性糖尿病(LADA),在病程早期与T2DM的临床表现类似,需要依靠GADA等胰岛自身抗体的检测或随访才能明确诊断。
2.胰岛β细胞功能遗传性缺陷所致特殊类型糖尿病:(1)线粒体DNA突变糖尿病:线粒体基因突变糖尿病是最为多见的单基因突变糖尿病,占中国成人糖尿病的0.6%。绝大多数线粒体基因突变糖尿病是由线粒体亮氨酸转运RNA基因[tRNALeu(UUR)]3243位的A?G(A3243G)突变所致。常见的临床表现为母系遗传、糖尿病和耳聋。对具有下列一种尤其是多种情况者应疑及线粒体基因突变糖尿病:①在家系内糖尿病的传递符合母系遗传;②起病早伴病程中胰岛β细胞分泌功能明显进行性减退或伴体重指数低且胰岛自身抗体检测阴性的糖尿病患者;③伴神经性耳聋的糖尿病患者;④伴中枢神经系统表现、骨骼肌表现、心肌病、视网膜色素变性、眼外肌麻痹或乳酸性酸中毒的糖尿病患者或家族中有上述表现者。对疑似本症者首先应进行tRNALeu(UUR)A3243G突变检测。(2)MODY:MODY是一种以常染色体显性遗传方式在家系内传递的早发但临床表现类似T2DM的疾病。MODY是临床诊断。目前通用的MODY诊断标准有以下3点:①家系内至少3代直系亲属均有糖尿病患者,且其传递符合常染色体显性遗传规律;②家系内至少有1个糖尿病患者的诊断年龄在25岁或以前;③糖尿病确诊后至少在2年内不需使用胰岛素控制血糖。目前国际上已发现了14种MODY类型[25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37],中国人常见的MODY类型及临床特征见

3.妊娠期糖尿病:定义和诊断见“第十七章糖尿病的特殊情况妊娠期高血糖管理”一节。
1.针对高危人群进行糖尿病筛查,有助于早期发现糖尿病。(B)
2.如果空腹血糖≥6.1 mmol/L或随机血糖≥7.8 mmol/L,建议行OGTT。(A)
3.糖尿病前期患者应给予生活方式干预,以降低发生糖尿病的风险。(A)
4.糖尿病前期患者强化生活方式干预效果不佳可考虑药物干预。(B)
5.血糖控制目标须个体化。(A)
6.对于合并其他心血管危险因素的T2DM患者,建议采取降糖、降压、调脂及合理应用阿司匹林治疗等综合管理措施,以预防心血管疾病和糖尿病微血管病变的发生。(A)
7.对于合并严重并发症的糖尿病患者,推荐至相关专科进行治疗。(B)
一级预防目标是控制2型糖尿病(T2DM)的危险因素,预防T2DM的发生;二级预防的目标是早发现、早诊断、早治疗T2DM患者,在已诊断的患者中预防糖尿病并发症的发生;三级预防的目标是延缓已存在的糖尿病并发症的进展、降低致残率和死亡率,改善患者的生存质量。
T2DM的一级预防指在一般人群中开展健康教育,提高人群对糖尿病防治的知晓度和参与度,倡导合理膳食、控制体重、适量运动、限盐、戒烟、限酒、心理平衡的健康生活方式,提高社区人群整体的糖尿病防治意识。
多项随机对照研究结果显示,糖耐量减低(IGT)人群接受适当的生活方式干预可延迟或预防T2DM的发生。中国大庆研究的生活方式干预组推荐患者增加蔬菜摄入量、减少酒精和单糖的摄入量,鼓励超重或肥胖患者减轻体重,增加日常活动量,每天进行至少20 min的中等强度活动[38]。生活方式干预6年,可使30年随访时累计发生T2DM的风险下降39%,T2DM发病中位时间推迟3.96年[39]。芬兰糖尿病预防研究(DPS)的生活方式干预组推荐个体化饮食和运动指导,每天至少进行30 min有氧运动和阻抗锻炼,目标是体重减少5%以上,脂肪摄入量<总热量的30%,平均随访7年,可使T2DM发生风险下降43%[40]。美国预防糖尿病计划(DPP)研究的生活方式干预组推荐患者摄入脂肪占总热量<25%的低脂饮食,如果体重减轻未达到标准,则进行热量限制;生活方式干预组中50%的患者体重下降了7%,74%的患者能够坚持每周至少150 min中等强度的运动;生活方式干预3年可使IGT进展为T2DM的风险下降58%[41]。随访15年后,生活方式干预预防T2DM的益处仍然存在[42]。此外,在其他国家的IGT患者中开展的生活方式干预研究同样也证实了生活方式干预预防T2DM发生的有效性。
在糖尿病前期人群中进行药物干预的临床试验结果显示,降糖药物二甲双胍、α-糖苷酶抑制剂、噻唑烷二酮类药物、胰高糖素样肽-1(GLP-1)受体激动剂以及减重药奥利司他等均可降低糖尿病前期人群发生糖尿病的风险,其中二甲双胍和阿卡波糖在糖尿病前期人群中长期应用的安全性证据较为充分,而其他药物长期应用时则需要全面考虑费用、不良反应、耐受性等因素。建议糖尿病前期患者应通过饮食控制和运动以降低糖尿病的发生风险,并定期随访及给予社会心理支持,以确保患者的生活方式改变能够长期坚持;定期检查血糖;同时密切关注其他心血管危险因素(如吸烟、高血压、血脂异常等),并给予适当的干预措施。具体目标为:(1)使超重或肥胖个体体重指数达到或接近24 kg/m2,或体重至少下降7%。(2)每日饮食总热量至少减少400~500 kcal(1 kcal=4.184 kJ),超重或肥胖者应减少500~750 kcal。(3)饱和脂肪酸摄入占总脂肪酸摄入的30%以下;每人每天食用盐的总量不超过5 g。(4)中等强度体力活动至少保持在150 min/周;(5)经过强化生活方式干预6个月效果不佳,可考虑药物干预[43]。
T2DM防治中的二级预防是指在高危人群中开展糖尿病筛查、及时发现糖尿病、及时进行健康干预等,在已诊断的患者中预防糖尿病并发症的发生。
高危人群的发现可以通过居民健康档案、基本公共卫生服务及机会性筛查(如在健康体检中或在进行其他疾病的诊疗时)等渠道。糖尿病筛查有助于早期发现糖尿病,提高糖尿病及其并发症的防治水平。因此,应针对高危人群进行糖尿病筛查[43, 44]。
1.糖尿病筛查的年龄和频率:对于糖尿病高危人群,宜及早开始进行糖尿病筛查;首次筛查结果正常者,宜每3年至少重复筛查一次[45]。
2.糖尿病筛查的方法:对于具有至少一项危险因素的高危人群应进一步进行空腹血糖或任意点血糖筛查,其中空腹血糖筛查是简单易行的方法,宜作为常规的筛查方法,但有漏诊的可能性。如果空腹血糖≥6.1 mmol/L或随机血糖≥7.8 mmol/L,建议行口服葡萄糖耐量试验(OGTT),同时检测空腹血糖和糖负荷后2 h血糖。
同时推荐采用中国糖尿病风险评分表,对20~74岁普通人群进行糖尿病风险评估。该评分表的制订源自2007至2008年全国14省市的糖尿病流行病学调查数据,评分值的范围为0~51分,总分≥25分者应进行OGTT[4, 46]。
糖尿病控制与并发症试验(DCCT)、英国前瞻性糖尿病研究(UKPDS)等严格控制血糖的临床研究结果显示,在处于糖尿病早期阶段的患者中,严格控制血糖可以显著降低糖尿病微血管病变的发生风险。随后的长期随访结果显示,早期严格控制血糖与长期随访中糖尿病微血管病变、心肌梗死及死亡的发生风险下降相关[47, 48]。表明对于新诊断的T2DM患者,早期严格控制血糖可以降低糖尿病微血管和大血管病变的发生风险。血糖控制目标须个体化。
对于新诊断、年轻、无严重并发症或合并症的T2DM患者,建议及早严格控制血糖,以降低糖尿病并发症的发生风险。
UKPDS研究结果显示,在新诊断的T2DM患者中,严格控制血压不但可以显著降低糖尿病大血管病变的发生风险,还可显著降低微血管病变的发生风险[49]。高血压优化治疗试验(HOT)以及其他抗高血压治疗临床试验的糖尿病亚组分析也显示,严格控制血压可以显著降低无明显血管并发症的糖尿病患者发生心血管事件的风险[50]。英国心脏保护研究-糖尿病亚组分析(HPS-DM)、阿托伐他汀糖尿病协作研究(CARDS)、盎格鲁-斯堪的那维亚心脏终点研究降脂分支(ASCOT-LLA)等大型临床研究显示,在没有明显血管并发症的糖尿病患者中,采用他汀类药物降低低密度脂蛋白胆固醇(LDL-C)可以显著降低心血管事件的发生风险[51, 52, 53]。
建议对于没有明显血管并发症但心血管风险高危或极高危的T2DM患者,应采取降糖、降压、调脂(主要是降低LDL-C)及合理应用阿司匹林治疗,以预防心血管事件和糖尿病微血管病变的发生。
三级预防是指延缓T2DM患者并发症的进展,降低致残率和死亡率,从而改善生活质量和延长寿命。
严格控制血糖可以降低已发生的早期糖尿病微血管病变(如非增殖性视网膜病变、微量白蛋白尿等)进一步发展的风险[47, 48]。然而,在糖尿病病程较长、年龄较大且具有多个心血管危险因素或已有心血管疾病的人群中,严格控制血糖对降低心血管事件和死亡风险的效应较弱。相反,控制糖尿病心血管风险行动研究(ACCORD)还显示,在上述人群中,严格控制血糖与全因死亡风险增加存在相关性[54, 55, 56]。有充分的临床研究证据表明,在伴有心血管疾病的T2DM患者中,应采用降压、调脂及抗血小板等综合治疗,以降低患者发生心血管事件和死亡的风险[57]。
建议对于糖尿病病程较长、年龄较大、已有心血管疾病的T2DM患者,继续采取降糖、降压、调脂(主要是降低LDL-C)、抗血小板治疗等综合管理措施,以降低心血管事件、微血管并发症进展及死亡的风险,但应遵循分层管理的原则。
1.糖尿病高危人群应进行糖尿病筛查。(A)
2.糖尿病患者在初诊时即应进行详细的评估。(A)
3.糖尿病患者应定期进行代谢控制状况及并发症评估。(A)
半数以上的2型糖尿病(T2DM)患者在疾病的早期无明显临床表现,糖尿病筛查可使这些患者得以早期发现、早期治疗,有助于提高糖尿病及其并发症的防治效率。
筛查对象为糖尿病高危人群。成年高危人群包括:(1)有糖尿病前期史;(2)年龄≥40岁;(3)体重指数(BMI)≥24 kg/m2和(或)中心型肥胖(男性腰围≥90 cm,女性腰围≥85 cm);(4)一级亲属有糖尿病史;(5)缺乏体力活动者;(6)有巨大儿分娩史或有妊娠期糖尿病病史的女性;(7)有多囊卵巢综合征病史的女性;(8)有黑棘皮病者;(9)有高血压史,或正在接受降压治疗者;(10)高密度脂蛋白胆固醇<0.90 mmol/L和(或)甘油三酯>2.22 mmol/L,或正在接受调脂药治疗者;(11)有动脉粥样硬化性心血管疾病(ASCVD)史;(12)有类固醇类药物使用史;(13)长期接受抗精神病药物或抗抑郁症药物治疗;(14)中国糖尿病风险评分(

筛查方法为两点法,即空腹血糖+75 g口服葡萄糖耐量试验(OGTT)2 h血糖。筛查结果正常者建议每3年筛查一次;筛查结果为糖尿病前期者,建议每年筛查一次。
规范的评估有助于明确糖尿病的临床类型,以指导治疗。对患者的全面评估还可以及时发现糖尿病并发症和伴发病,并给予相应的治疗,从而改善患者的预后。有效的评估可明确患者是否合并ASCVD、心力衰竭和慢性肾脏病(CKD),对于制订合理的降糖治疗方案具有重要意义。
1.问诊:应详细询问患者的临床信息,如年龄、糖尿病及其并发症的症状、既往史、个人史、家族史。既往史应包括患者过去体重变化的情况,是否有高血压、血脂异常、冠心病、脑血管病变、周围血管病变、脂肪肝、自身免疫病、肿瘤、睡眠呼吸暂停综合征及治疗情况。个人史包括吸烟、饮酒、饮食等情况。家族史包括一级亲属是否患糖尿病及治疗情况,是否有高血压、血脂异常、冠心病、脑血管病变、周围血管病变、脂肪肝、自身免疫病、肿瘤等疾病。此外,还应了解患者的文化、工作、经济及宗教信仰情况,这些信息有助于制订个体化的综合控制目标和治疗方案。
2.体格检查:应常规测量血压、心率、身高、体重、腰围、臀围,并计算BMI和腰臀比。对肥胖的糖尿病患者(尤其是青少年),应检查是否存在黑棘皮病。T2DM患者在诊断时即可出现并发症,还应检查视力、神经系统(如踝反射、针刺痛觉、震动觉、压力觉、温度觉)、足背动脉搏动、下肢和足部皮肤。
3.实验室检查和其他检查:包括空腹和餐后2 h(或OGTT 2 h)血糖、胰岛素、C肽、糖化血红蛋白(HbA1c)、糖化血清白蛋白、肝功能、肾功能、血尿酸、血脂、尿常规、尿白蛋白/肌酐比值(UACR),并根据血肌酐水平计算估算的肾小球滤过率(eGFR)。UACR和eGFR联合可以更好地评估糖尿病患者肾病的严重程度。如尿酮体阳性,应测定血β-羟丁酸、血电解质并进行血气分析检查。疑有心力衰竭者建议检测血清B型利钠肽水平。如胰岛素和C肽水平较低,应测定谷氨酸脱羧酶抗体(GADA)等自身抗体。疑有特殊类型糖尿病时,可根据患者临床特征作基因检查或染色体检查。
T2DM患者在诊断时就应做眼底检查和神经病变的检查[58]。眼底检查可以使用免散瞳眼底照相机拍摄眼底照片,如异常则转诊至眼科进行进一步评估。踝反射、针刺痛觉、震动觉、压力觉、温度觉检查异常者宜进一步行电生理学检查(如神经传导速度测定)及定量感觉测定。尿常规或eGFR异常者,应做泌尿系统超声检查,必要时用核素法测定肾小球滤过率。尿常规中红细胞或白细胞增加以及有其他证据提示患者的肾损害可能有糖尿病肾病以外的因素时,应建议患者行肾穿刺活检。
糖尿病患者初诊时应常规做心电图,伴高血压或心电图异常或心脏听诊异常者应做超声心动图检查。心电图有心肌缺血表现或有胸闷、心前区疼痛症状者应做运动试验或冠状动脉CT血管成像,必要时行冠状动脉造影检查。有心律失常者应做动态心电图检查,伴高血压者宜做动态血压监测以了解全天血压波动情况。足背动脉搏动减弱或足部皮肤有溃疡者应测定踝肱指数(ABI),必要时行下肢血管超声检查及下肢动脉造影。
超重或肥胖的糖尿病患者以及肝功能异常的糖尿病患者应做腹部超声检查了解是否伴脂肪肝及胆石症,必要时行上腹部CT或磁共振成像检查。
应对复诊患者进行规范的评估以明确患者代谢控制状况及并发症和伴发病的情况。每次复诊时应询问患者膳食情况、体重是否有变化、是否有糖尿病症状、是否有低血糖症状、是否存在并发症及伴发病的症状、对现有治疗方案是否满意。应测量患者的血压、心率,并检查下肢及足部皮肤。每3个月测量体重、腰围和臀围。
使用胰岛素及胰岛素促泌剂治疗的患者应在医师指导下进行自我血糖监测,每次复诊时医师应查看患者的自测血糖结果,这是评估患者血糖控制状况的重要依据。如患者血糖波动大或疑有低血糖,建议行持续葡萄糖监测。对于糖尿病症状明显或存在应激因素时,应及时检查尿酮体、血β-羟丁酸、血电解质,必要时做血气分析。建议血糖控制良好者每6个月测定1次HbA1c,血糖控制不佳或近期调整了治疗方案者3个月测定1次HbA1c。血脂、肝功能、肾功能、血尿酸、尿常规、UACR正常者可每年复查1次这些指标,异常者可根据具体情况决定复查的频次(
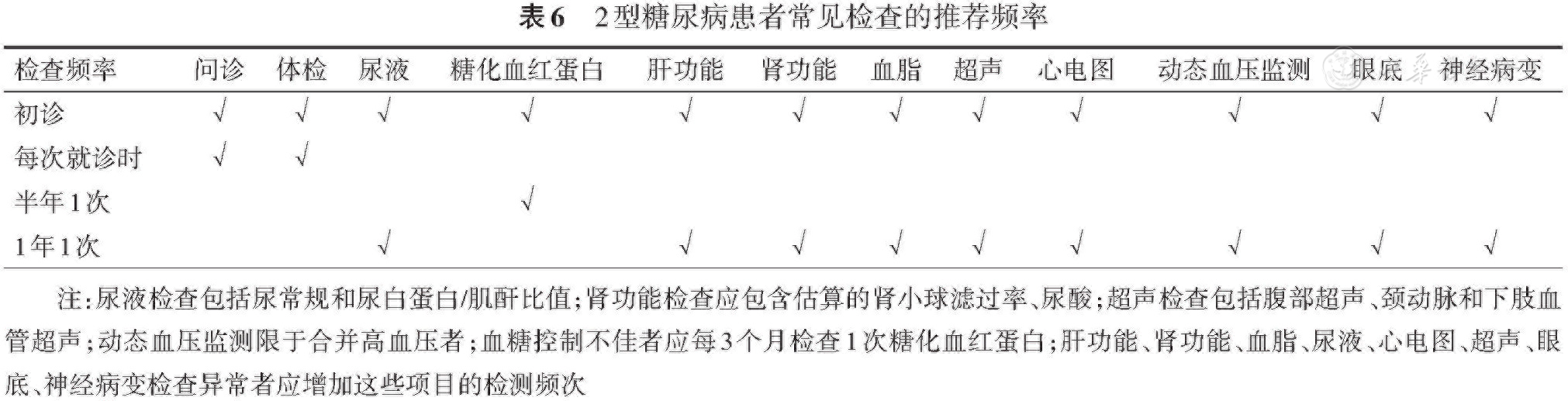
糖尿病视网膜病变、糖尿病肾病和糖尿病神经病变是常见的糖尿病慢性并发症,建议T2DM患者每年筛查1次这些并发症,1型糖尿病患者在诊断后5年每年筛查1次[58, 59]。已经确诊的糖尿病并发症如病情稳定可每6个月重新评估1次,如病情有变化应立即重新评估,必要时请相关科室会诊。心、脑血管疾病及下肢动脉狭窄是糖尿病常见的合并症,如患者出现相关症状应立即进行相应的检查。
糖尿病患者是肿瘤高危人群,如患者出现不明原因的纳差、乏力、体重下降或其他肿瘤相关症状,应及时做相关评估以明确是否伴有肿瘤。
1.糖尿病患者均应接受糖尿病自我管理教育,以掌握自我管理所需的知识和技能。(B)
2.糖尿病自我管理教育应以患者为中心,尊重和响应患者的个人爱好、需求和价值观,并以此来指导临床决策。(A)
3. DSMES可改善临床结局和减少花费。(B)
4.医护工作者应在最佳时机为糖尿病患者提供尽可能个体化的糖尿病自我管理教育。(B)
5.评估糖尿病相关心理压力,并采取有效的应对措施,改善患者心理问题。(B)
糖尿病是一种长期慢性疾病,患者的日常行为和自我管理能力是影响糖尿病控制状况的关键因素之一,因此,糖尿病的控制不是传统意义上的治疗而是系统的管理。糖尿病自我管理教育和支持(DSMES)致力于临床、教育、社会心理和行为方面的照顾,可促进患者不断掌握疾病管理所需的知识和技能,对糖尿病患者的临床、心理和社会行为方面都有明确的益处[60, 61]。接受糖尿病自我管理教育的患者,血糖控制优于未接受教育的患者,拥有更积极的态度、更丰富的糖尿病知识和较好的糖尿病自我管理行为,更有战胜疾病的信心。不同糖尿病患者的需求、目标和生活经验是调整照护计划的主要依据[61, 62]。糖尿病自我管理教育方案特别是以循证为基础的结构化课程,虽然在传授方法、内容和技术的使用、以人为本的哲学和具体目标方面各不相同[63],但都可以有效促进自我管理,提高患者的知识、技能和动机,并最终改善生物医学、行为和心理社会结果。
糖尿病治疗的近期目标是通过控制高血糖和代谢紊乱来消除糖尿病症状和防止出现急性并发症,糖尿病治疗的远期目标是通过良好的代谢控制达到预防慢性并发症、提高患者生活质量和延长寿命的目的。为了达到这一目标,应建立完善的糖尿病教育和管理体系,主要推荐如下[64, 65, 66]。
1.糖尿病患者在诊断后,应接受糖尿病自我管理教育,掌握相关知识和技能,并且不断学习。
2. DSMES应以患者为中心,尊重和响应患者的个人爱好、需求和价值观,以此指导临床决策。
3.糖尿病自我管理教育是患者的必修教育课,该课程应包含延迟和预防2型糖尿病(T2DM)的内容,并注重个体化。
4. DSMES可改善临床结局和减少花费。
5.当提供DSMES时,健康教育提供者应该考虑治疗负担和患者自我管理的效能和社会与家庭支持的程度。
6.医护工作者应在最佳时机为糖尿病患者提供尽可能全面的糖尿病自我管理教育。
7.在规范化的专科糖尿病教育护士培养基础上,为患者提供糖尿病自我管理教育。
8.重视专职糖尿病教育者培养和糖尿病教育管理跨专业团队的建设,加强对随访和相关科研的培训与支持。
每位糖尿病患者一旦确诊即应接受糖尿病教育,教育的目标是使患者充分认识糖尿病并掌握糖尿病的自我管理能力。糖尿病自我管理教育的总体目标是支持决策制定、自我管理行为、问题解决和与医疗团队积极合作,糖尿病患者自我管理的教育可提高患者病情控制水平,最终改善临床结局、健康状况和生活质量[67, 68]。
糖尿病自我管理教育的方式包括个体教育、集体教育、个体和集体教育相结合以及远程教育[69],可以是大课堂式、小组式,也可以是个体式。小组式或个体化的教育针对性更强。教育内容包括饮食、运动、血糖监测和自我管理能力的指导。
集体教育包括小组教育和大课堂教育。小组教育指糖尿病教育者针对多个患者的共同问题同时与他们沟通并给予指导,每次教育时间为1 h左右,患者人数10~15人为佳。大课堂教育[70]指以课堂授课的形式由医学专家或糖尿病专业护士为患者讲解糖尿病相关知识,每次课时1.5 h左右,患者人数在50~200人不等,主要针对对糖尿病缺乏认识的患者以及糖尿病高危人群。
个体教育指糖尿病教育者与患者进行一对一的沟通和指导,适合一些需要重复练习的技巧学习,如自我注射胰岛素、自我血糖监测(SMBG)。在制定健康教育目标时应重视患者的参与,在方案实施过程中,细化行为改变的目标,重视患者的反馈,以随时对方案做出调整[70]。
远程教育为通过手机应用程序和互联网平台开展远程教育,宣传糖尿病自我管理相关知识,提高患者的自我管理技能[69, 71, 72]。
根据患者需求和不同的具体教育目标以及资源条件,可采取多种形式的教育,包括演讲、讨论、示教与反示教、场景模拟、角色扮演、电话咨询、联谊活动、媒体宣传等[70]。
糖尿病的教育和指导应该是长期和及时的,特别是当血糖控制较差、需调整治疗方案时,或因出现并发症需进行胰岛素治疗时,必须给予具体的教育和指导。而且教育应尽可能标准化和结构化,并结合各地条件做到“因地制宜”。
应包含对教育对象的基本评估,确定需解决的问题,制定有针对性的目标及计划、实施的方案以及效果评价。
1.评估:收集资料,包括病情、知识、行为、心理。
2.发现问题:找出患者在知识和行为上主要存在的问题。
3.制定目标:确定经教育后患者在知识和行为上所能达到的目标。
4.列出计划:根据患者情况(初诊、随诊),体现个体化和可行性。
5.实施:采用具体教育方法和技巧对患者进行教育。
6.效果评价:反馈频度、内容,制定下一步教育方案[70]。
1. DSMES首要强调多学科团队:每个糖尿病管理单位应有1名受过专门培训的糖尿病教育护士,设立专职糖尿病教育者的岗位,以保证教育的质量。共同照护模式是糖尿病管理模式中的一种高度有效形式。共同照护门诊的基本成员应包括专科医师、营养师、经认证的护理教育师及运动指导师[73, 74, 75, 76]。DSMES是一个持续的行为改变闭环,自我管理处方作为其实践工具和支持形式,需要多方团队与技术支持,联合实现规范化、系统化的糖尿病自我管理[77]。
2. DSMES的关键时间点[78]:包括:(1)新诊断糖尿病时;(2)每年进行健康评估和并发症防治时;(3)出现新的复杂因素影响自我管理时;(4)健康状态和照护发生改变时。
3. DSMES的有效评估:逐步建立定期随访和评估系统,以确保所有患者都能进行咨询并得到及时的正确指导。
1.糖尿病的自然进程。
2.糖尿病的临床表现。
3.糖尿病的危害及如何防治急慢性并发症。
4.个体化的治疗目标。
5.个体化的生活方式干预措施和饮食计划。
6.规律运动和运动处方。
7.饮食、运动、口服药、胰岛素治疗及规范的胰岛素注射技术。
8.血糖测定结果的意义和应采取的干预措施。
9. SMBG、尿糖监测(当血糖监测无法实施时)和胰岛素注射等具体操作技巧。
10.口腔护理、足部护理、皮肤护理的具体技巧。
11.特殊情况应对措施(如疾病、低血糖、应激和手术)。
12.糖尿病妇女受孕计划及监护。
13.糖尿病患者的社会心理适应。
14.糖尿病自我管理的重要性。
糖尿病合并相关痛苦、焦虑、抑郁等问题非常普遍,对治疗和预后影响巨大,应给予更多的关注[79, 80]。个性化的DSMES及心理干预能提高患者应对糖尿病相关问题的能力,更好地改善情绪障碍及糖代谢状态。一些用于生活幸福感、糖尿病相关痛苦、焦虑、抑郁的量表,如WHO-5、PAID、DDS、BAI、SAS、PHQ-9、SDS等,可以筛查及初步判定严重程度[81, 82, 83]。
糖尿病知识及技能的培训、多维度的社会心理支持是糖尿病患者应对心理压力的有效手段,需定期评估及调整,具体内容包括:(1)伴有焦虑、抑郁的糖尿病患者血糖控制难度及并发症发生风险均增加,应定期规范筛查,评估糖尿病相关并发症[84];(2)社会心理支持,如同伴支持模式有助于缓解糖尿病患者的心理压力,提高心理弹性,使患者具有正确应对和良好适应的能力[85],降低糖尿病相关痛苦、抑郁等负性情绪的发生[86, 87];(3)糖尿病患者伴精神心理问题需转诊精神专科治疗[88]。
数字化健康应用程序及互联网、物联网技术的飞速发展推动了糖尿病教育管理的信息化和标准化,通过与传统的DSMES相结合,向个人提供有关知识和服务。智能手机设备和无线网络的进步增加了糖尿病患者的接受程度和能力,计算机视觉/视频游戏、可穿戴设备以及增强和虚拟现实技术的发展,为糖尿病教育管理提供了更多手段,为改善糖尿病患者的自我管理提供了更多的机会[89, 90, 91]。
新技术包括利用短信、智能手机和基于网络的应用程序以及远程健康管理系统管理糖尿病。但是,有必要对这些技术优化研究,并进行相关培训以适应糖尿病自我管理背景下的饮食和身体活动行为[92]。
DSMES需要与时俱进,通过互联网远程医疗提供的在线糖尿病教育管理比传统的面对面教育能惠及更多人群,患者就医更便捷且无交通成本。T2DM自我管理处方使得糖尿病教育管理的标准化和同质化成为可能,让偏远地区的患者有机会获得同质化医疗保健,尤其在疫情期间,线上管理减少了糖尿病患者交叉感染的机会,但其作用仍存在局限性[93, 94, 95]。线上管理可作为线下管理的延伸,应鼓励患者加入线上管理系统,并且配备专职的线下和线上教育者,由专业组织培训并颁发培训合格的资质证书,从而规范线上管理方案[96]。
1.T2DM的治疗策略应该是综合性的,包括血糖、血压、血脂、体重的控制,抗血小板治疗和改善生活方式等措施。(A)
2.对大多数非妊娠成年T2DM患者,合理的HbA1c控制目标为<7%。(A)
3.HbA1c控制目标应遵循个体化原则,年龄较轻、病程较短、预期寿命较长、无并发症、未合并心血管疾病的T2DM患者在没有低血糖及其他不良反应的情况下可采取更严格的HbA1c控制目标,反之则采取相对宽松的HbA1c目标。(B)
4.生活方式干预和二甲双胍为T2DM患者高血糖的一线治疗;生活方式干预是T2DM的基础治疗措施,应贯穿于治疗的始终;若无禁忌证,二甲双胍应一直保留在糖尿病的药物治疗方案中。(A)
5.一种降糖药治疗血糖不达标者,应采用2种甚至3种不同作用机制的药物联合治疗,也可加用胰岛素治疗。(A)
6.合并ASCVD或心血管风险高危的T2DM患者,不论其HbA1c是否达标,只要没有禁忌证都应在二甲双胍的基础上加用具有ASCVD获益证据的GLP-1RA或SGLT2i。(A)
7.合并CKD或心力衰竭的T2DM患者,不论其HbA1c是否达标,只要没有禁忌证都应在二甲双胍的基础上加用SGLT2i;合并CKD的T2DM患者,如不能使用SGLT2i可考虑选用GLP-1RA。(A)
2型糖尿病(T2DM)患者常合并代谢综合征的一个或多个组分,如高血压、血脂异常、肥胖等,使T2DM并发症的发生风险、进展速度及危害显著增加。因此,科学、合理的T2DM治疗策略应该是综合性的,包括血糖、血压、血脂和体重的控制(

血糖的控制在糖尿病代谢管理中具有重要的意义。糖化血红蛋白(HbA1c)是反映血糖控制状况的最主要指标(
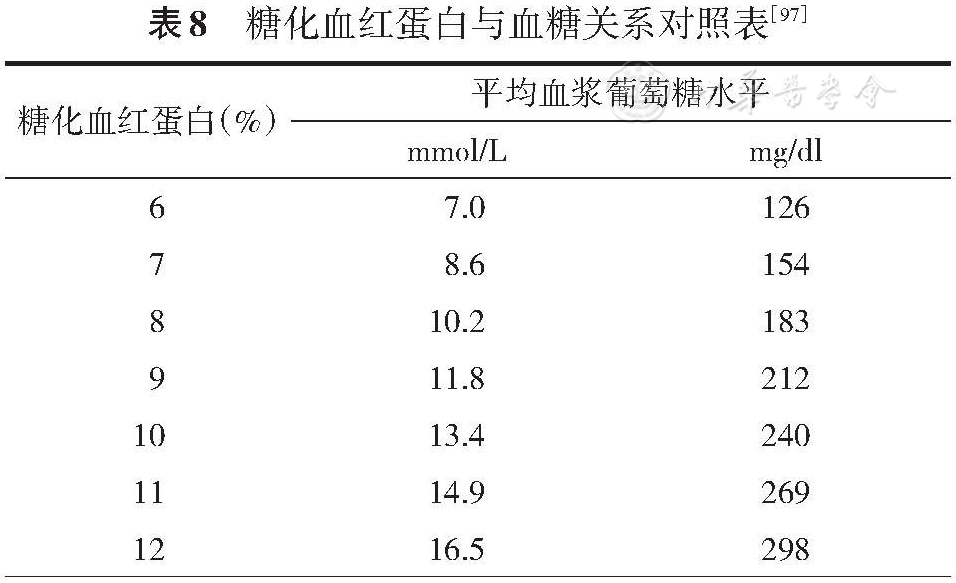
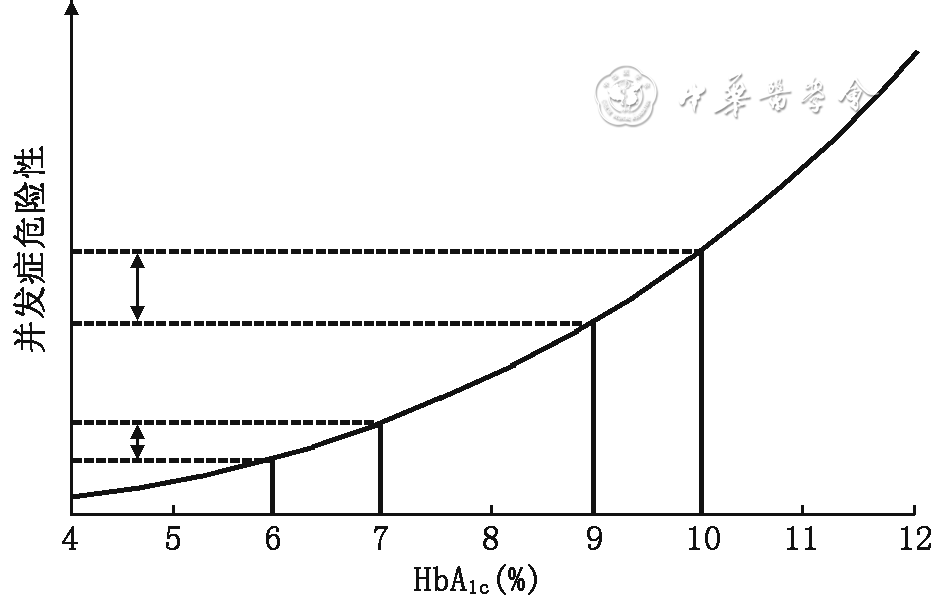
HbA1c控制目标应遵循个体化原则,即根据患者的年龄、病程、健康状况、药物不良反应风险等因素实施分层管理,并对血糖控制的风险/获益比、成本/效益比等方面进行科学评估,以期达到最合理的平衡[97, 98]。年龄较轻、病程较短、预期寿命较长、无并发症、未合并心血管疾病的T2DM患者在无低血糖或其他不良反应的情况下可采取更严格的HbA1c控制目标(如<6.5%,甚至尽量接近正常)。年龄较大、病程较长、有严重低血糖史、预期寿命较短、有显著的微血管或大血管并发症或严重合并症的患者可采取相对宽松的HbA1c目标(

HbA1c虽然是反映血糖控制状况的“金标准”,但也存在不足,如不能反映即刻血糖水平,也不能反映血糖的波动情况[97, 98]。自我血糖监测(SMBG)和持续葡萄糖监测(CGM)可以很好地弥补HbA1c的上述不足。推荐一般成人T2DM患者SMBG的空腹血糖控制目标为4.4~7.0 mmol/L,非空腹血糖目标为<10.0 mmol/L。空腹血糖和非空腹血糖目标也应个体化,老年患者、低血糖高风险患者、预期寿命较短、有严重并发症或合并症的患者可适当放宽。CGM可提供丰富的血糖信息,据此可计算出葡萄糖目标范围时间(TIR)、葡萄糖高于目标范围时间(TAR)、葡萄糖低于目标范围时间(TBR)及很多反映血糖波动的参数,对优化血糖管理具有重要意义。
血压、血脂和体重管理亦应遵循个体化原则,即根据患者的年龄、病程、预期寿命、并发症或合并症严重程度等进行综合考虑。HbA1c未能达标不应视为治疗失败,控制指标的任何改善对患者都可能有益。
儿童、孕妇、住院和病情危重患者等特殊人群的控制标准参见相关章节。
控制高血糖的策略是综合性的,包括生活方式管理、血糖监测、糖尿病教育和应用降糖药物等措施[2, 3, 4, 5, 7, 8, 9]。医学营养治疗和运动治疗是生活方式管理的核心,是控制高血糖的基础治疗措施,应贯穿于糖尿病管理的始终[58, 97, 98, 101, 102]。二甲双胍是目前最常用的降糖药,具有良好的降糖作用、多种降糖作用之外的潜在益处、优越的费效比、良好的药物可及性、临床用药经验丰富等优点,且不增加低血糖风险[97, 98]。虽然二甲双胍缺乏安慰剂对照的心血管结局试验(CVOT),但许多研究结果显示二甲双胍具有心血管获益,而且目前已发表的显示钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)和胰高糖素样肽-1受体激动剂(GLP-1RA)具有心血管和肾脏获益的CVOT研究都是在二甲双胍作为背景治疗的基础上取得的[97, 98, 106, 107, 108, 109, 110, 111, 112, 113]。因此,推荐生活方式管理和二甲双胍作为T2DM患者高血糖的一线治疗。若无禁忌证,二甲双胍应一直保留在糖尿病的治疗方案中[58, 97, 98, 99, 103]。有二甲双胍禁忌证或不耐受二甲双胍的患者可根据情况选择胰岛素促泌剂、α-糖苷酶抑制剂、噻唑烷二酮类(TZD)、二肽基肽酶Ⅳ抑制剂(DPP-4i)、SGLT2i或GLP-1RA[58]。
T2DM是一种进展性疾病,随着病程的进展,血糖有逐渐升高的趋势,控制高血糖的治疗强度也应随之加强。如单独使用二甲双胍治疗而血糖未达标,则应进行二联治疗[58, 97, 98, 99, 103]。二联治疗的药物可根据患者病情特点选择。如果患者低血糖风险较高或发生低血糖的危害大(如独居老人、驾驶者等)则尽量选择不增加低血糖风险的药物,如α-糖苷酶抑制剂、TZD、DPP-4i、SGLT2i或GLP-1RA[98, 103]。如患者需要降低体重则选择有体重降低作用的药物,如SGLT2i或GLP-1RA[98, 103]。如患者HbA1c距离目标值较大则选择降糖作用较强的药物,如胰岛素促泌剂或胰岛素[98]。部分患者在诊断时HbA1c较高,可起始二联治疗。在新诊断T2DM患者中进行的维格列汀联合二甲双胍用于T2DM早期治疗的有效性(VERIFY)研究结果显示,DPP-4i与二甲双胍的早期联合治疗相比二甲双胍单药起始的阶梯治疗,血糖控制更持久,并显著降低了治疗失败的风险[114],提示早期联合治疗的优势。
二联治疗3个月不达标的患者,应启动三联治疗,即在二联治疗的基础上加用一种不同机制的降糖药物。如三联治疗血糖仍不达标,则应将治疗方案调整为多次胰岛素治疗(基础胰岛素加餐时胰岛素或每日多次预混胰岛素)。采用多次胰岛素治疗时应停用胰岛素促分泌剂。一些患者在单药或二联治疗时甚至在诊断时即存在显著的高血糖症状乃至酮症,可直接给予短期强化胰岛素治疗,包括基础胰岛素加餐时胰岛素、每日多次预混胰岛素或胰岛素泵治疗。
并发症和合并症是T2DM患者选择降糖药的重要依据。基于GLP-1RA和SGLT2i的CVOT研究证据[106, 107, 108, 109, 110, 111, 112, 113],推荐合并动脉粥样硬化性心血管疾病(ASCVD)或心血管风险高危的T2DM患者,不论其HbA1c是否达标,只要没有禁忌证都应在二甲双胍的基础上加用具有ASCVD获益证据的GLP-1RA或SGLT2i。合并慢性肾脏病(CKD)或心力衰竭的T2DM患者,不论其HbA1c是否达标,只要没有禁忌证都应在二甲双胍的基础上加用SGLT2i。合并CKD的T2DM患者,如不能使用SGLT2i,可考虑选用GLP-1RA。如果患者在联合GLP-1RA或SGLT2i治疗后3个月仍然不能达标,可启动包括胰岛素在内的三联治疗。合并CKD的糖尿病患者易出现低血糖,合并ASCVD或心力衰竭的患者低血糖危害性大,应加强血糖监测。如有低血糖,应立即处理。
HbA1c联合SMBG和CGM是优化血糖管理的基础。如果HbA1c已达标,但SMBG和CGM的结果显示有低血糖或血糖波动很大,亦需调整治疗方案。在调整降糖治疗方案时应加强SMBG、CGM及低血糖知识的宣教,尤其是低血糖风险大及低血糖危害大的患者。
T2DM高血糖治疗的简易路径见
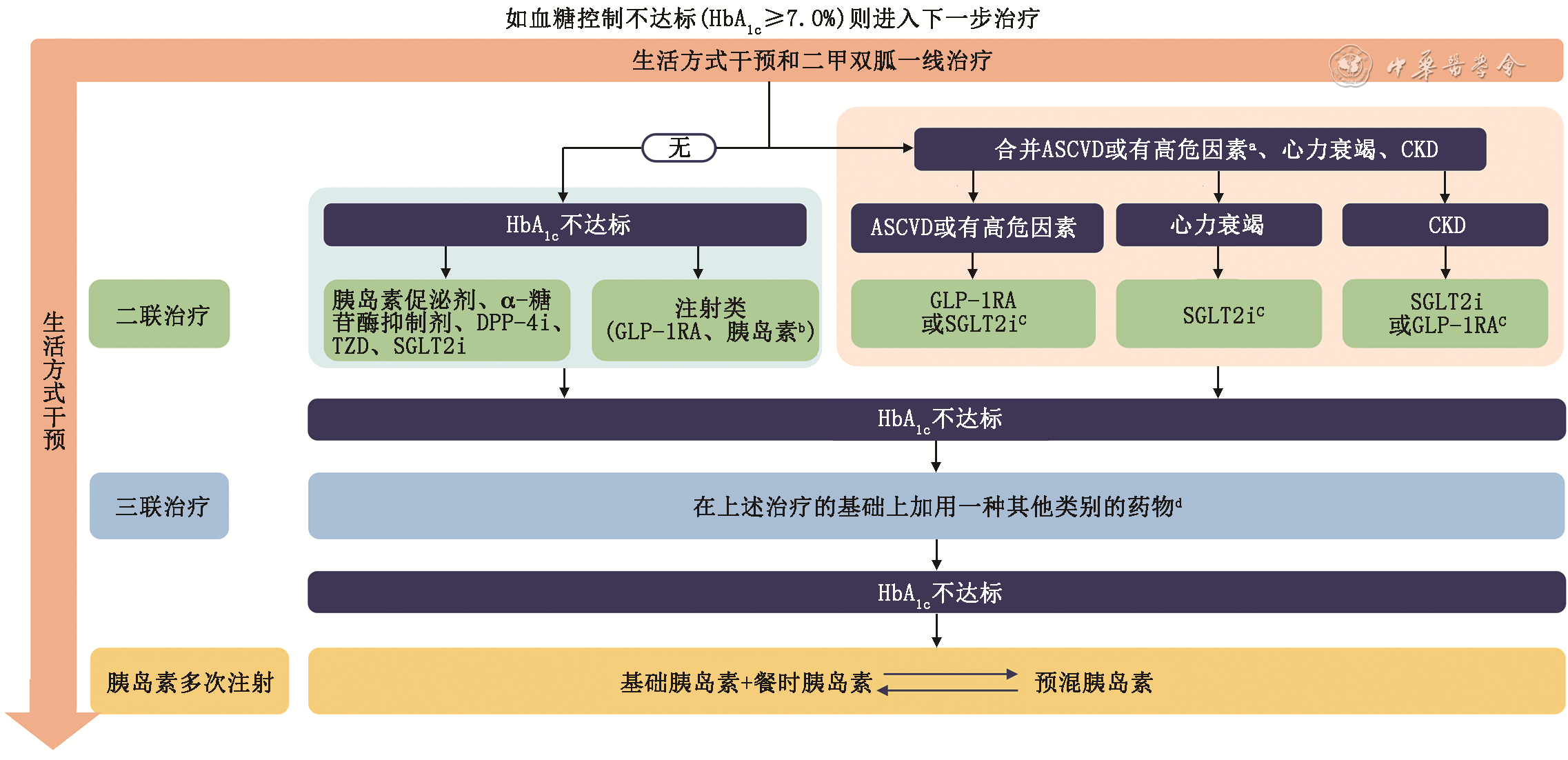
注:HbA1c为糖化血红蛋白;ASCVD为动脉粥样硬化性心血管疾病;CKD为慢性肾脏病;DPP-4i为二肽基肽酶Ⅳ抑制剂;TZD为噻唑烷二酮;SGLT2i为钠-葡萄糖共转运蛋白2抑制剂;GLP-1RA为胰高糖素样肽-1受体激动剂。a高危因素指年龄≥55岁伴以下至少1项:冠状动脉或颈动脉或下肢动脉狭窄≥50%,左心室肥厚;b通常选用基础胰岛素;c加用具有ASCVD、心力衰竭或CKD获益证据的GLP-1RA或SGLT2i;d有心力衰竭者不用TZD
1. T2DM及糖尿病前期患者均需要接受个体化医学营养治疗,由熟悉糖尿病医学营养治疗的营养(医)师或综合管理团队(包括糖尿病教育者)指导患者完成。(A)
2.应在评估患者营养状况的基础上,设定合理的医学营养治疗目标和计划,控制总能量的摄入,合理、均衡分配各种营养素,达到患者的代谢控制目标,并尽可能满足个体饮食喜好。(B)
糖尿病医学营养治疗是临床条件下对糖尿病或糖尿病前期患者的营养问题采取特殊干预措施,参与患者的全程管理,包括进行个体化营养评估、营养诊断、制定相应营养干预计划,并在一定时期内实施及监测。通过改变膳食模式与习惯、调整营养素结构、由专科营养(医)师给予个体化营养治疗,可以降低2型糖尿病(T2DM)患者的糖化血红蛋白(HbA1c)0.3%~2.0%,并有助于维持理想体重及预防营养不良。近年的研究证实,对肥胖的T2DM患者采用强化营养治疗可使部分患者的糖尿病得到缓解。营养治疗已经成为防治糖尿病及其并发症的重要手段。
参考国内外卫生行业标准和指南的要求,确定营养治疗的目标如下[58, 60, 115, 116, 117, 118, 119, 120]:
1.促进并维持健康饮食习惯,强调选择合适的食物,并改善整体健康。
2.达到并维持合理体重,获得良好的血糖、血压、血脂的控制以及延缓糖尿病并发症的发生。
3.提供营养均衡的膳食。为满足个人背景、文化等需求,可选择更多类型的营养丰富的食物,并能够进行行为改变。
1.糖尿病前期或糖尿病患者应当接受个体化能量平衡计划,目标是既要达到或维持理想体重,又要满足不同情况下营养需求。
2.对于所有超重或肥胖的糖尿病患者,应调整生活方式,控制总能量摄入,至少减轻体重5%。
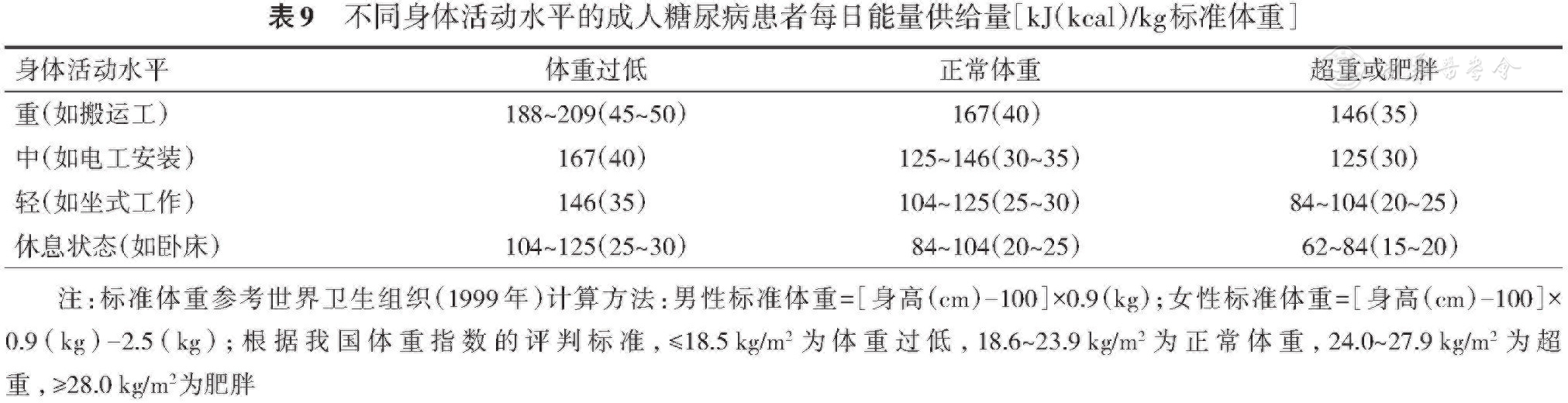
3.建议糖尿病患者能量摄入参考通用系数方法,按照105~126 kJ(25~30 kcal)·kg??(标准体重)·d??计算能量摄入。再根据患者身高、体重、性别、年龄、活动量、应激状况等进行系数调整(
1.不同类型的脂肪对血糖及心血管疾病的影响有较大差异,故难以精确推荐膳食中脂肪的供能。一般认为,膳食中脂肪提供的能量应占总能量的20%~30%。如果是优质脂肪(如单不饱和脂肪酸和n-3多不饱和脂肪酸组成的脂肪),脂肪供能比可提高到35%。
2.应尽量限制饱和脂肪酸、反式脂肪酸的摄入量。单不饱和脂肪酸和n-3多不饱和脂肪酸(如鱼油、部分坚果及种子)有助于改善血糖和血脂,可适当增加。
3.参考2016年中国居民膳食指南,应控制膳食中胆固醇的过多摄入。
1.社区动脉粥样硬化危险(ARIC)研究结果显示,碳水化合物所提供的能量占总能量的50%~55%时全因死亡风险最低[121]。考虑到我国糖尿病患者的膳食习惯,建议大多数糖尿病患者膳食中碳水化合物所提供的能量占总能量的50%~65%[117]。餐后血糖控制不佳的糖尿病患者,可适当降低碳水化合物的供能比。不建议长期采用极低碳水化合物膳食。
2.在控制碳水化合物总量的同时应选择低血糖生成指数碳水化合物,可适当增加非淀粉类蔬菜、水果、全谷类食物,减少精加工谷类的摄入。全谷类应占总谷类的一半以上[119]。全谷类摄入与全因死亡、冠心病、T2DM及结直肠癌风险呈负相关[122]。
3.进餐应定时定量。注射胰岛素的患者应保持碳水化合物摄入量与胰岛素剂量和起效时间相匹配。
4.增加膳食纤维的摄入量。成人每天膳食纤维摄入量应>14 g/1 000 kcal[119]。膳食纤维摄入量与全因死亡、冠心病、T2DM及结直肠癌风险呈负相关[122]。
5.严格控制蔗糖、果糖制品(如玉米糖浆)的摄入。
6.喜好甜食的糖尿病患者可适当摄入糖醇和非营养性甜味剂。
1.肾功能正常的糖尿病患者,推荐蛋白质的供能比为15%~20%,并保证优质蛋白占总蛋白的一半以上。
2.有显性蛋白尿或肾小球滤过率下降的糖尿病患者蛋白质摄入应控制在每日0.8 g/kg体重。
1.不推荐糖尿病患者饮酒。若饮酒应计算酒精中所含的总能量。
2.女性一天饮酒的酒精量不超过15 g,男性不超过25 g(15 g酒精相当于350 ml啤酒、150 ml葡萄酒或45 ml蒸馏酒)。每周饮酒不超过2次。
3.应警惕酒精可能诱发的低血糖,尤其是服用磺脲类药物或注射胰岛素及胰岛素类似物的患者应避免空腹饮酒并严格监测血糖。
1.食盐摄入量限制在每天5 g以内,合并高血压的患者可进一步限制摄入量。
2.同时应限制摄入含盐高的食物,如味精、酱油、盐浸等加工食品、调味酱等。
糖尿病患者容易缺乏B族维生素、维生素C、维生素D以及铬、锌、硒、镁、铁、锰等多种微量营养素,可根据营养评估结果适量补充。长期服用二甲双胍者应防止维生素B12缺乏。无微量营养素缺乏的糖尿病患者,无需长期大量补充维生素、微量元素以及植物提取物等制剂,其长期安全性和改善临床结局的作用有待验证。
对糖尿病患者来说,并不推荐特定的膳食模式。地中海膳食、素食、低碳水化合物膳食、低脂肪低能量膳食均在短期有助于体重控制,但要求在专业人员的指导下完成,并结合患者的代谢目标和个人喜好(如风俗、文化、宗教、健康理念、经济状况等),同时监测血脂、肾功能以及内脏蛋白质的变化。
营养教育与管理有助于改善糖耐量,降低糖尿病前期发展为糖尿病的风险,并有助于减少糖尿病患者慢性并发症的发生。应对糖尿病患者制订营养教育与管理的个体化目标与计划,并与运动、戒烟一起作为糖尿病及其并发症防治的基础。
1.成人T2DM患者每周至少150 min中等强度有氧运动。(B)
2.成人T2DM患者应增加日常身体活动,减少静坐时间。(B)
3.伴有急性并发症或严重慢性并发症时,慎行运动治疗。(B)
运动锻炼在2型糖尿病(T2DM)患者的综合管理中占重要地位。规律运动可增加胰岛素敏感性、改善体成分及生活质量,有助于控制血糖、减少心血管危险因素而且对糖尿病高危人群一级预防效果显著。流行病学研究结果显示,规律运动8周以上可将T2DM患者糖化血红蛋白(HbA1c)降低0.66%;坚持规律运动的糖尿病患者死亡风险显著降低[123, 124]。
T2DM患者运动时应遵循以下原则:
1.运动治疗宜在相关专业人员指导下进行。运动前进行必要的健康评测和运动能力评估,有助于保证运动治疗的安全性和科学性。
2.成年T2DM患者每周至少150 min(如每周运动5 d、每次30 min)中等强度(50%~70%最大心率,运动时有点费力,心跳和呼吸加快但不急促)的有氧运动。即使1次进行短时的体育运动(如10 min),累计30 min/d,也是有益的[125]。
3.中等强度的体育运动包括健步走、太极拳、骑车、乒乓球、羽毛球和高尔夫球等。较高强度的体育运动包括快节奏舞蹈、有氧健身操、游泳、骑车上坡、足球、篮球等[123]。
4.如无禁忌证,每周最好进行2~3次抗阻运动(两次锻炼间隔≥48 h),锻炼肌肉力量和耐力。锻炼部位应包括上肢、下肢、躯干等主要肌肉群,训练强度宜中等。联合进行抗阻运动和有氧运动可获得更大程度的代谢改善[124]。
5.运动处方的制定需遵循个体化原则。运动项目要与患者的年龄、病情、喜好及身体承受能力相适应,并定期评估,适时调整运动计划。运动可穿戴设备的使用(如计步器),有助于提升运动依从性[126]。运动前后要加强血糖监测,运动量大或激烈运动时应建议患者临时调整饮食及药物治疗方案,以免发生低血糖。运动中要注意及时补充水分。
6.养成健康的生活习惯。培养活跃的生活方式,如增加日常身体活动、打破久坐行为、减少静坐时间[127],将有益的体育运动融入到日常生活中。
7.严重低血糖、糖尿病酮症酸中毒等急性代谢并发症、合并急性感染、增殖性视网膜病变、严重心脑血管疾病(不稳定性心绞痛、严重心律失常、一过性脑缺血发作)等情况下禁忌运动,病情控制稳定后方可逐步恢复运动[123]。
8. T2DM患者只要感觉良好,一般不必因高血糖而推迟运动。如果在进行剧烈的体力活动时血糖>16.7 mmol/L,则应谨慎,确保其补充充足的水分[128]。
1.建议所有的糖尿病患者不要吸烟及使用其他烟草类产品及电子烟,并尽量减少二手烟暴露。(A)
2.对于吸烟和使用电子烟的糖尿病患者,应将戒烟咨询及其他形式的治疗纳入常规的糖尿病诊疗和护理之中。(A)
吸烟有害健康。吸烟不仅是导致癌症、呼吸系统和心脑血管系统疾病的重要危险因素,也与糖尿病及其并发症的发生发展密切相关。在一项中国人群的大样本前瞻性研究中发现,城市中吸烟的男性糖尿病发病风险是不吸烟者的1.18倍,且开始吸烟的年龄越小,吸烟的量越大,糖尿病发病风险越高[129]。一项纳入了6 000多例糖尿病患者的横断面研究显示,吸烟是糖化血红蛋白(HbA1c)升高的独立危险因素,吸烟数量每增加20包/年,HbA1c升高0.12%[130]。此外,父母吸烟(被动吸烟)会增加儿童和青少年的肥胖和胰岛素抵抗风险[131]。
吸烟还会增加糖尿病各种并发症的发生风险,尤其是大血管病变。一项纳入46个前瞻性研究的Meta分析显示,吸烟能使糖尿病患者全因死亡风险增加48%,冠心病的发病风险增加54%,脑卒中风险增加44%,心肌梗死风险增加52%[132]。吸烟还可损伤肾小球的结构和功能[133],增加尿蛋白和糖尿病肾病的发生[134]。
近年来,电子烟获得了公众的关注和欢迎,但电子烟可能引起肺损伤、血管内皮功能障碍及氧化应激等[135]。
戒烟能显著降低心血管疾病发生率及全因死亡率[136]。戒烟还能延缓糖尿病肾病的发展[137]。戒烟能使高密度脂蛋白胆固醇水平升高而降低低密度脂蛋白胆固醇,从而有利于预防糖尿病并发症[138]。
尽管有研究显示戒烟在短期内会导致2型糖尿病(T2DM)患者体重增加、血糖升高,但这一作用随着时间延长会逐渐减弱,在3~5年后基本消失,并不能掩盖戒烟对糖尿病患者的有益影响及长期获益[136, 139]。一项在中国男性T2DM患者中的流行病学调查显示,随着吸烟量的增加,空腹血糖和HbA1c均呈上升趋势,而在戒烟者中,随着戒烟年限的增加,空腹血糖和HbA1c均逐渐下降,戒烟≥10年可使空腹血糖和HbA1c水平分别降低0.44 mmol/L和0.41%[140]。
糖尿病患者常存在易饥症状,戒烟后尼古丁的食欲抑制作用解除,进食增加,可引起体重增加。戒烟还会改变肠道菌群,亦可导致体重增加[141]。然而,体重增加的不利影响并不能抵消戒烟的有利影响。因此,医师应鼓励患者戒烟,并注重戒烟期间的体重管理。戒烟措施包括行为干预和药物干预。
行为干预包括:
1.对糖尿病患者进行常规教育,告知患者吸烟的危害、对糖尿病的不利影响、戒烟的益处以及戒烟的措施等。
2.向患者开放戒烟的短期咨询和戒烟热线。
3.评估患者吸烟的状态及尼古丁依赖程度,从而制定相应的戒烟目标。
4.为患者提供心理和行为支持,包括争取其家人及朋友或病友的群体支持,为患者制定个体化饮食及运动治疗方案和戒烟计划,并定期进行随访。
5.对戒烟成功者,进行6~12个月的随访(如打电话等形式),有助于防止复吸。
药物干预可以使用尼古丁替代治疗、安非他酮、伐尼克兰等药物帮助患者戒烟,这些药物可以增加戒烟的成功率[142],可以在戒烟专家指导下使用。此外,这些药物干预可能会延迟戒烟后的体重增加。因此,戒烟者可以首先关注戒烟,然后再关注体重管理。此外,使用二甲双胍、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、胰高糖素样肽-1受体激动剂(GLP-1RA)等有助于减轻体重的降糖药物,在治疗糖尿病的同时有助于抑制戒烟后的体重增加。与最低限度的干预或常规护理相比,联合药物和行为干预可将戒烟成功率提高到70%~100%[143]。
1.二甲双胍为T2DM患者控制高血糖的一线用药和药物联合中的基本用药。(A)
2.磺脲类药物、格列奈类药物、α-糖苷酶抑制剂、TZD、DPP-4i、SGLT2i、GLP-1RA和胰岛素是主要联合用药。(B)
3. T2DM患者HbA1c不达标时可根据低血糖风险、体重、经济条件、药物可及性等因素选择联用药物。(A)
4.无论HbA1c水平是否达标,T2DM患者合并ASCVD、ASCVD高风险、心力衰竭或慢性肾脏病,建议首先联合有心血管疾病和慢性肾脏病获益证据的GLP-1RA或SGLT2i。(A)
高血糖的药物治疗多基于纠正导致人类血糖升高的两个主要病理生理改变,即胰岛素抵抗和胰岛素分泌受损。根据作用效果的不同,口服降糖药可分为主要以促进胰岛素分泌为主要作用的药物和通过其他机制降低血糖的药物,前者主要包括磺脲类、格列奈类、二肽基肽酶Ⅳ抑制剂(DPP-4i),通过其他机制降低血糖的药物主要包括双胍类、噻唑烷二酮类(TZD)、α-糖苷酶抑制剂和钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)。
糖尿病的医学营养治疗和运动治疗是控制2型糖尿病(T2DM)高血糖的基本措施。在饮食和运动不能使血糖控制达标时,应及时采用包括口服药治疗在内的药物治疗。T2DM是一种进展性疾病。在T2DM的自然病程中,胰岛β细胞功能随着病程的延长而逐渐下降,胰岛素抵抗的程度变化不大。因此,随着T2DM病程的进展,对外源性的血糖控制手段的依赖逐渐增大。临床上常需要口服降糖药物及口服药物和注射降糖药[胰岛素、胰高糖素样肽-1(GLP-1)受体激动剂(GLP-1RA)]间的联合治疗。
目前临床上使用的双胍类药物主要是盐酸二甲双胍。双胍类药物的主要药理作用是通过减少肝脏葡萄糖的输出和改善外周胰岛素抵抗而降低血糖。许多国家和国际组织制定的糖尿病诊治指南中均推荐二甲双胍作为T2DM患者控制高血糖的一线用药和药物联合中的基本用药。对临床试验的系统评价结果显示,二甲双胍的降糖疗效(去除安慰剂效应后)为糖化血红蛋白(HbA1c)下降1.0%~1.5%,并可减轻体重[144, 145, 146]。在我国T2DM人群中开展的临床研究显示,二甲双胍的降糖疗效为HbA1c下降0.7%~1.0%[147, 148]。在500~2 000 mg/d剂量范围之间,二甲双胍疗效呈现剂量依赖效应[147, 149]。一项在我国未治疗的T2DM患者人群中开展的研究显示,二甲双胍缓释片与普通片的疗效和总体胃肠道不良事件发生率相似[150]。在我国T2DM患者中开展的临床研究显示,在低剂量二甲双胍治疗的基础上联合DPP-4i的疗效与将二甲双胍的剂量继续增加所获得的血糖改善程度和不良事件发生的比例相似[151, 152]。二甲双胍的疗效与体重无关[153, 154]。英国前瞻性糖尿病研究(UKPDS)结果证明,二甲双胍还可减少肥胖T2DM患者的心血管事件和死亡风险[155]。在我国伴冠心病的T2DM患者中开展的针对二甲双胍与磺脲类药物对再发心血管事件影响的随机对照试验结果显示,二甲双胍的治疗与主要心血管事件的显著下降相关[156]。单独使用二甲双胍不增加低血糖风险,但二甲双胍与胰岛素或胰岛素促泌剂联合使用时可增加发生低血糖的风险。二甲双胍的主要不良反应为胃肠道反应。从小剂量开始并逐渐加量是减少其不良反应的有效方法。在已经耐受低剂量二甲双胍的患者中继续增加二甲双胍的剂量不增加胃肠道不良反应。二甲双胍与乳酸性酸中毒发生风险间的关系尚不确定[157]。双胍类药物禁用于肾功能不全[血肌酐水平男性>132.6 μmol/L(1.5 mg/dl),女性>123.8 μmol/L(1.4 mg/dl)或估算的肾小球滤过率(eGFR)<45 ml·min??·(1.73 m?)??][158]、肝功能不全、严重感染、缺氧或接受大手术的患者。正在服用二甲双胍者,eGFR为45~59 ml·min??·(1.73 m?)??之间时不需停用,可以适当减量继续使用。造影检查如使用碘化对比剂时,应暂时停用二甲双胍,在检查完至少48 h且复查肾功能无恶化后可继续用药[159]。长期服用二甲双胍可引起维生素B12水平下降[158, 160, 161]。长期使用二甲双胍者可每年测定1次血清维生素B12水平,如缺乏应适当补充维生素B12。
磺脲类药物属于胰岛素促泌剂,主要药理作用是通过刺激胰岛β细胞分泌胰岛素,增加体内的胰岛素水平而降低血糖。磺脲类药物可使HbA1c降低1.0%~1.5%(去除安慰剂效应后)[162]。前瞻性、随机分组的临床研究结果显示,磺脲类药物的使用与糖尿病微血管病变和大血管病变发生的风险下降相关[48, 54, 163]。一项心血管结局试验(CVOT)显示,格列美脲组与利格列汀组的主要不良心血管事件发生风险差异无统计学意义,但格列美脲组低血糖发生率高于利格列汀组[164]。目前在我国上市的磺脲类药物主要为格列本脲、格列美脲、格列齐特、格列吡嗪和格列喹酮。磺脲类药物如果使用不当可导致低血糖,特别是在老年患者和肝、肾功能不全者;磺脲类药物还可导致体重增加。有肾功能轻度不全的患者如使用磺脲类药物宜选择格列喹酮。
格列奈类药物为非磺脲类胰岛素促泌剂,我国上市的有瑞格列奈、那格列奈和米格列奈。此类药物主要通过刺激胰岛素的早时相分泌而降低餐后血糖,也有一定的降空腹血糖作用,可使HbA1c降低0.5%~1.5%[165]。此类药物需在餐前即刻服用,可单独使用或与其他降糖药联合应用(磺脲类除外)。在我国新诊断的T2DM人群中,瑞格列奈与二甲双胍联合治疗较单用瑞格列奈可更显著地降低HbA1c,但低血糖的风险显著增加[166]。
格列奈类药物的常见不良反应是低血糖和体重增加,但低血糖的风险和程度较磺脲类药物轻。格列奈类药物可以在肾功能不全的患者中使用[165]。
TZD主要通过增加靶细胞对胰岛素作用的敏感性而降低血糖。目前在我国上市的TZD主要有罗格列酮和吡格列酮及其与二甲双胍的复方制剂。在我国T2DM患者中开展的临床研究结果显示,TZD可使HbA1c下降0.7%~1.0%(去除安慰剂效应后)[167, 168, 169]。卒中后胰岛素抵抗干预研究(IRIS)表明,在有胰岛素抵抗伴动脉粥样硬化性心血管疾病(ASCVD)的糖耐量减低(IGT)患者中,与安慰剂相比,吡格列酮能减少卒中和心肌梗死再发生的风险,同时降低新发糖尿病的风险[170]。
TZD单独使用时不增加低血糖风险,但与胰岛素或胰岛素促泌剂联合使用时可增加低血糖风险。体重增加和水肿是TZD的常见不良反应,这些不良反应在与胰岛素联合使用时表现更加明显。TZD的使用与骨折和心力衰竭风险增加相关[171, 172]。有心力衰竭[纽约心脏学会(NYHA)心功能分级Ⅱ级以上]、活动性肝病或氨基转移酶升高超过正常上限2.5倍、严重骨质疏松和有骨折病史的患者应禁用本类药物。
α-糖苷酶抑制剂通过抑制碳水化合物在小肠上部的吸收而降低餐后血糖,适用于以碳水化合物为主要食物成分的餐后血糖升高的患者。推荐患者每日2~3次,餐前即刻吞服或与第一口食物一起嚼服。国内上市的α-糖苷酶抑制剂有阿卡波糖、伏格列波糖和米格列醇。在包括中国人在内的T2DM人群中开展的临床研究的系统评价结果显示,α-糖苷酶抑制剂可以使HbA1c降低0.50%,并能使体重下降[173]。在中国T2DM人群开展的临床研究结果显示,在初诊的糖尿病患者中每天服用300 mg阿卡波糖的降糖疗效与每天服用1 500 mg二甲双胍的疗效相当[174];在初诊的糖尿病患者中阿卡波糖的降糖疗效与DPP-4i(维格列汀)相当[175];在二甲双胍治疗的基础上阿卡波糖的降糖疗效与DPP-4i(沙格列汀)相当[176]。
α-糖苷酶抑制剂可与双胍类、磺脲类、TZD或胰岛素联合使用。在冠心病伴IGT的人群中进行的研究显示,阿卡波糖不增加受试者主要复合心血管终点事件风险,但能减少IGT向糖尿病转变的风险[177]。
α-糖苷酶抑制剂的常见不良反应为胃肠道反应(如腹胀、排气等)。从小剂量开始,逐渐加量是减少不良反应的有效方法。单独服用本类药物通常不会发生低血糖。用α-糖苷酶抑制剂的患者如果出现低血糖,治疗时需使用葡萄糖或蜂蜜,而食用蔗糖或淀粉类食物纠正低血糖的效果差。
DPP-4i通过抑制二肽基肽酶Ⅳ(DPP-4)而减少GLP-1在体内的失活,使内源性GLP-1水平升高。GLP-1以葡萄糖浓度依赖的方式增加胰岛素分泌,抑制胰高糖素分泌[178]。目前在国内上市的DPP-4i为西格列汀、沙格列汀、维格列汀、利格列汀和阿格列汀。在我国T2DM患者中的临床研究结果显示,DPP-4i的降糖疗效(去除安慰剂效应后)为降低HbA1c 0.4%~0.9%[147, 148, 175, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192],其降糖效果与基线HbA1c有关,即基线HbA1c水平越高,降低血糖和HbA1c的绝对幅度越大。多项荟萃分析显示,在不同的治疗方案或不同的人群中,去除安慰剂效应后5种DPP-4i降低血糖的疗效相似[193, 194, 195]。单独使用DPP-4i不增加发生低血糖的风险。DPP-4i对体重的作用为中性[178]。在二甲双胍单药治疗(二甲双胍剂量≥1 500 mg/d)不达标的T2DM患者联合沙格列汀与联合格列美脲相比,两组HbA1c降幅和达标率(HbA1c<7%)均无差异,但联合沙格列汀组“安全达标”率(HbA1c<7%、未发生低血糖且体重增加<3%)高于联合格列美脲组(分别为43.3%和31.3%,P=0.019)[196],尤其在基线HbA1c<8%、病程<5年或基线体重指数(BMI)≥25 kg/m2的患者差异更明显。在心血管安全性方面,沙格列汀、阿格列汀、西格列汀、利格列汀的CVOT研究结果均显示,不增加T2DM患者3P或4P主要心血管不良事件(MACE)风险及死亡风险[197, 198, 199,
SGLT2i是一类近年受到高度重视的新型口服降糖药物[103,
SGLT2i单药治疗能降低HbA1c 0.5%~1.2%,在二甲双胍基础上联合治疗可降低HbA1c 0.4%~0.8%。SGLT2i还有一定的减轻体重和降压作用。SGLT2i可使体重下降0.6~3.0 kg。SGLT2i可单用或联合其他降糖药物治疗成人T2DM,目前在1型糖尿病(T1DM)、青少年及儿童中无适应证。SGLT2i单药治疗不增加低血糖风险,但与胰岛素或胰岛素促泌剂联用时则增加低血糖风险。因此,SGLT2i与胰岛素或胰岛素促泌剂联用时应下调胰岛素或胰岛素促泌剂的剂量。SGLT2i在轻、中度肝功能受损(Child-Pugh A、B级)患者中使用无需调整剂量,在重度肝功能受损(Child-Phgh C级)患者中不推荐使用。SGLT2i不用于eGFR<30 ml·min??·(1.73 m?)??的患者。
SGLT2i的常见不良反应为泌尿系统和生殖系统感染及与血容量不足相关的不良反应,罕见不良反应包括糖尿病酮症酸中毒(DKA)。DKA可发生在血糖轻度升高或正常时,多存在DKA诱发因素或属于DKA高危人群[
SGLT2i在一系列大型心血管结局及肾脏结局的研究中显示了心血管及肾脏获益,包括恩格列净心血管结局研究(EMPA-REG OUTCOME)[110]、卡格列净心血管评估研究(CANVAS)[111]、达格列净对心血管事件的影响(DECLARE-TIMI 58)[112]、评估艾托格列净有效性和安全性心血管结局(VERTIS CV)试验[
1. T2DM患者在生活方式和口服降糖药联合治疗的基础上,若血糖仍未达到控制目标,尽早(3个月)开始胰岛素治疗。(A)
2. T2DM患者的胰岛素起始治疗可以采用每日1~2次胰岛素。(A)
3.对于HbA1c≥9.0%或空腹血糖≥11.1 mmol/L同时伴明显高血糖症状的新诊断T2DM患者可考虑实施短期(2周至3个月)胰岛素强化治疗。(A)
4.胰岛素强化治疗可以采用每天2~4次注射或CSII方法。(A)
5. T2DM患者采用餐时+基础胰岛素(4次/d)与每日3次预混胰岛素类似物治疗的降糖疗效和安全性相似。(A)
6.在糖尿病病程中(包括新诊断的T2DM),出现无明显诱因的体重显著下降时,应该尽早使用胰岛素治疗。(A)
胰岛素治疗是控制高血糖的重要手段。T1DM患者需依赖胰岛素维持生命,也必须使用胰岛素控制高血糖,并降低糖尿病并发症的发生风险[
医务人员和患者必须认识到,与口服药相比,胰岛素治疗涉及更多环节,如药物选择、治疗方案、注射装置、注射技术、自我血糖监测(SMBG)、持续葡萄糖监测(CGM)、根据血糖监测结果所采取的行动等[
根据来源和化学结构的不同,胰岛素可分为动物胰岛素、人胰岛素和胰岛素类似物。根据作用特点的差异,胰岛素又可分为超短效胰岛素类似物、常规(短效)胰岛素、中效胰岛素、长效胰岛素、长效胰岛素类似物、预混胰岛素、预混胰岛素类似物以及双胰岛素类似物。胰岛素类似物与人胰岛素相比控制血糖的效能相似,但在模拟生理性胰岛素分泌和减少低血糖发生风险方面优于人胰岛素。
德谷胰岛素和甘精胰岛素U300(300 U/ml)是两种新的长效胰岛素类似物。德谷胰岛素半衰期为25 h,作用时间为42 h。甘精胰岛素U300半衰期为19 h,作用时间为36 h,比甘精胰岛素U100(100 U/ml)作用持续更长[
1.起始胰岛素治疗的时机:(1)T1DM患者在起病时就需要胰岛素治疗,且需终身胰岛素替代治疗[
2.起始胰岛素治疗时胰岛素制剂的选择:根据患者具体情况,可选用基础胰岛素、预混胰岛素或双胰岛素类似物起始胰岛素治疗。
(1)基础胰岛素:基础胰岛素包括中效胰岛素和长效胰岛素类似物。当仅使用基础胰岛素治疗时,保留原有各种口服降糖药物,不必停用胰岛素促泌剂[
使用方法:继续口服降糖药治疗,联合中效胰岛素或长效胰岛素类似物睡前注射。起始剂量为0.1~0.2 U·kg??·d??。HbA1c>8.0%者,可考虑0.2~0.3 U·kg??·d??起始[
如3个月后空腹血糖控制理想但HbA1c不达标,或每天基础胰岛素用量已经达到最大剂量血糖仍未达标,应考虑调整胰岛素的治疗方案。
(2)预混胰岛素[
(3)双胰岛素类似物:目前上市的双胰岛素类似物只有德谷门冬双胰岛素(IDegAsp),该药一般从0.1~0.2 U·kg??·d??开始,于主餐前注射,根据空腹血糖水平调整剂量直至达标。肥胖或HbA1c>8.0%的患者,可选择更高剂量起始。德谷门冬双胰岛素每天1次治疗,剂量达到0.5 U·kg-1·d-1或30~40 U餐后血糖仍控制不佳,或患者每天有两次主餐时,可考虑改为每天注射2次[
1.多次皮下注射胰岛素:在胰岛素起始治疗的基础上,经过充分的剂量调整,如患者的血糖水平仍未达标或出现反复的低血糖,需进一步优化治疗方案。可以采用餐时+基础胰岛素(2~4次/d)或每日2~3次预混胰岛素类似物进行胰岛素强化治疗。使用方法如下:
(1)餐时+基础胰岛素:根据中餐前、晚餐前和睡前血糖水平分别调整三餐前的胰岛素用量,根据空腹血糖水平调整睡前基础胰岛素用量,每3~5天调整1次,根据血糖水平每次调整的剂量为1~4 U,直至血糖达标。开始使用餐时+基础胰岛素方案时,可在基础胰岛素的基础上采用仅在一餐前(如主餐)加用餐时胰岛素的方案。之后根据血糖的控制情况决定是否在其他餐前加用餐时胰岛素。
(2)每日2~3次预混胰岛素(预混人胰岛素每日2次,预混胰岛素类似物每日2~3次):根据睡前和三餐前血糖水平进行胰岛素剂量调整,每3~5天调整1次,直到血糖达标。研究显示,在T2DM患者采用餐时+基础胰岛素(4次/d)或每日3次预混胰岛素类似物进行治疗时,二者在HbA1c降幅、低血糖发生率、胰岛素总剂量和对体重的影响方面无明显差别[
2. CSII:参见第十二章。
T1DM患者一般需要多次皮下注射胰岛素或CSII,即需要长期的胰岛素强化治疗。对于HbA1c≥9.0%或空腹血糖≥11.1 mmol/L伴明显高血糖症状的新诊断T2DM患者,可实施短期胰岛素强化治疗,治疗时间在2周至3个月为宜,治疗目标为空腹血糖4.4~7.0 mmol/L,非空腹血糖<10.0 mmol/L,可暂时不以HbA1c达标作为治疗目标。
短期胰岛素强化治疗方案可以采用多次皮下注射胰岛素、每日2~3次预混胰岛素或CSII。如果采用的是多次皮下注射胰岛素方案,血糖监测方案需每周至少3 d,每天3~4个时间点。根据中餐前、晚餐前和睡前血糖水平分别调整早、中、晚餐前的胰岛素用量,根据空腹血糖水平调整睡前基础胰岛素用量,每3~5天调整1次,每次调整的胰岛素剂量为1~4 U,直到血糖达标。如果采用的是每日2~3次预混胰岛素,血糖监测方案需每周至少3 d,每天3~4个时间点。根据睡前和餐前血糖水平进行胰岛素剂量调整,每3~5天调整1次,根据血糖水平每次调整的剂量为1~4 U,直到血糖达标。如果采用的是CSII,血糖监测方案需每周至少3 d,每天5~7个时点。根据血糖水平调整剂量直至血糖达标。胰岛素强化治疗时应同时对患者进行医学营养及运动治疗,并加强对糖尿病患者的教育。
对于短期胰岛素强化治疗未能诱导缓解的患者,是否继续使用胰岛素治疗或改用其他药物治疗,应由糖尿病专科医师根据患者的具体情况来确定。对治疗达标且临床缓解者,可以考虑定期(如3个月)随访监测;当血糖再次升高,即空腹血糖≥7.0 mmol/L或餐后2 h血糖≥10.0 mmol/L的患者重新起始药物治疗。
围手术期、感染、妊娠时胰岛素的应用见相关章节。
T2DM患者的胰岛素治疗路径见
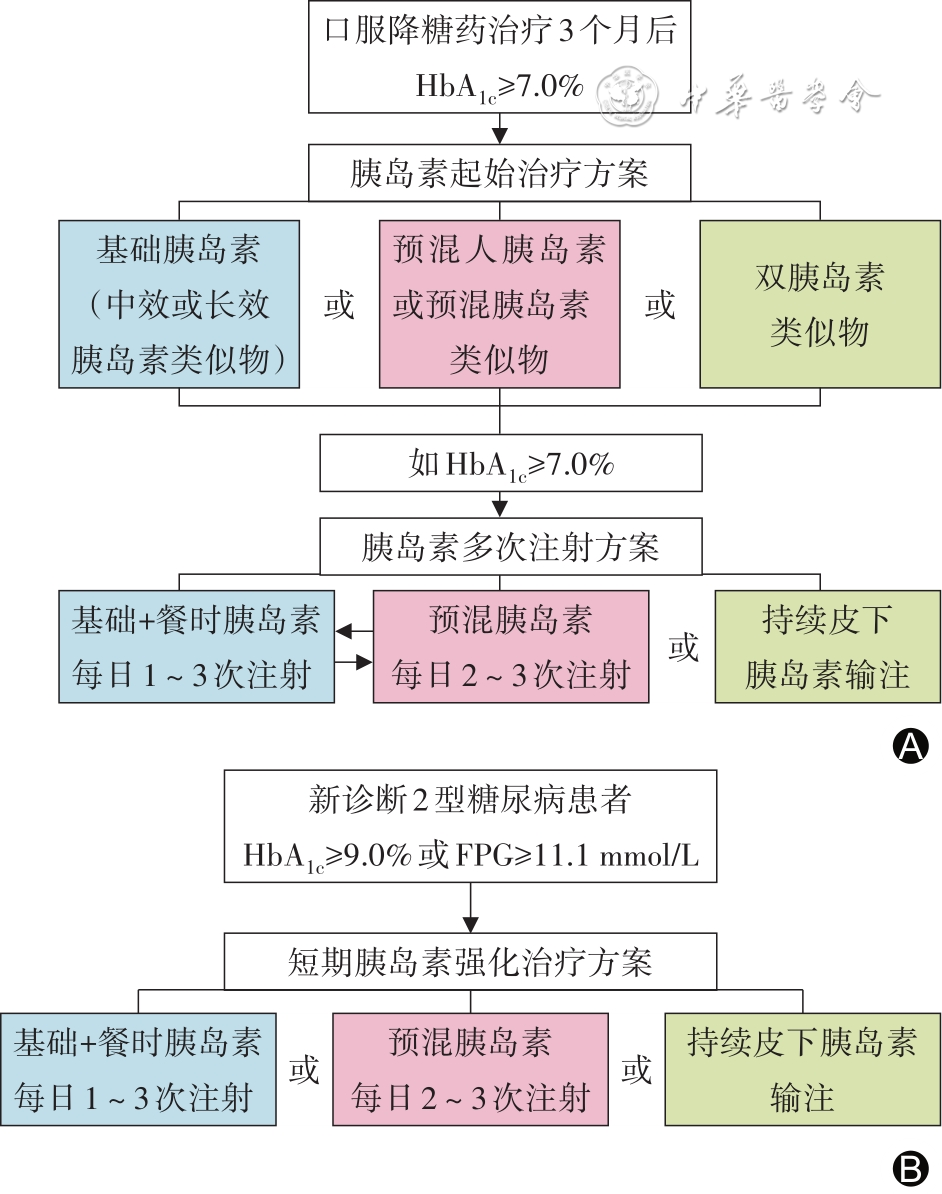
注:HbA1c为糖化血红蛋白;FPG为空腹血糖
GLP-1RA通过激活GLP-1受体以葡萄糖浓度依赖的方式刺激胰岛素分泌和抑制胰高糖素分泌,同时增加肌肉和脂肪组织葡萄糖摄取,抑制肝脏葡萄糖的生成而发挥降糖作用,并可抑制胃排空,抑制食欲。GLP-1受体广泛分布于胰岛细胞、胃肠道、肺、脑、肾脏、下丘脑、心血管系统、肝脏、脂肪细胞和骨骼肌等[
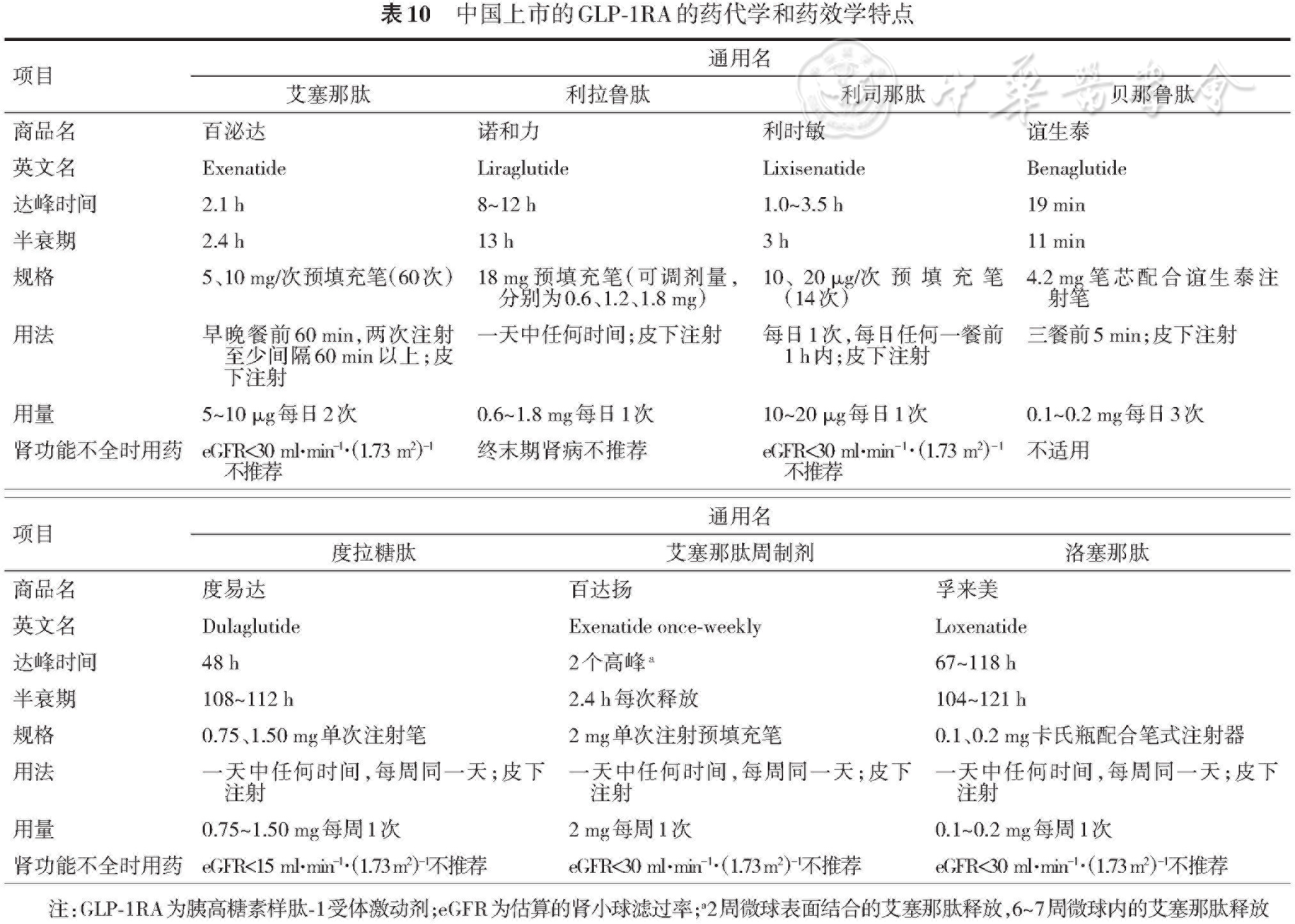
我国上市的GLP-1RA依据药代动力学分为短效的贝那鲁肽、艾塞那肽、利司那肽和长效的利拉鲁肽、艾塞那肽周制剂、度拉糖肽和洛塞那肽。根据其分子结构的特点GLP-1RA可分为两类:与人GLP-1氨基酸序列同源性较低,基于美洲蜥蜴唾液多肽Exendin-4结构合成的如艾塞那肽、利司那肽和洛塞那肽;与人GLP-1氨基酸序列同源性较高,基于人GLP-1结构,通过少数氨基酸残基替换、加工修饰得到的,如利拉鲁肽、贝那鲁肽、度拉糖肽等(贝那鲁肽为天然人GLP-1)。
GLP-1RA可有效降低血糖,能部分恢复胰岛β细胞功能,降低体重,改善血脂谱及降低血压。GLP-1RA可单独使用或与其他降糖药物联合使用。包括中国T2DM患者的多项临床研究均证实,GLP-1RA能有效改善空腹及餐后2 h血糖,降低HbA1c,降低体重。口服降糖药二甲双胍和(或)磺脲类治疗失效后,加用GLP-1RA可进一步改善血糖。艾塞那肽联合磺脲类和(或)二甲双胍与安慰剂相比可降低HbA1c为0.8%,体重下降1.1 kg[
GLP-1RA的主要不良反应为轻~中度的胃肠道反应,包括腹泻、恶心、腹胀、呕吐等。这些不良反应多见于治疗初期,随着使用时间延长,不良反应逐渐减轻。一些在中国尚未上市的GLP-1RA也显示了良好的降糖疗效和心血管获益,如司美格鲁肽(Semaglutide)[
GLP-1RA与基础胰岛素的复方制剂如甘精胰岛素利司那肽复方制剂(iGlarLixi)[
1.超重和肥胖成人T2DM患者的管理目标为减轻体重5%~10%。(A)
2.超重和肥胖成人T2DM患者的体重管理方式包括生活方式干预、药物、手术等综合手段。(A)
3.肥胖的成人T2DM患者尽量采用生活方式及药物治疗,血糖仍然控制不佳者建议代谢手术治疗。(B)
超重和肥胖是2型糖尿病(T2DM)发病的重要危险因素。T2DM患者常伴有超重和肥胖,肥胖进一步增加T2DM患者的心血管疾病发生风险。体重管理不仅是T2DM治疗的重要环节,还有助于延缓糖尿病前期向T2DM的进展。超重和肥胖的T2DM患者通过合理的体重管理,不仅可以改善血糖控制、减少降糖药物的使用,其中有部分糖尿病患者还可以停用降糖药物,达到糖尿病“缓解”的状态。此外,体重管理对糖尿病患者的代谢相关指标,如血压、血脂等,同样具有改善作用。
临床证据显示,体重管理可以明显改善T2DM患者的血糖控制、胰岛素抵抗和β细胞功能[
超重和肥胖成人T2DM患者的体重管理策略包括生活方式干预、使用具有减重作用的降糖药或减肥药、代谢手术等综合手段。
针对超重和肥胖的T2DM患者,体重减轻3%~5%是体重管理的基本要求[
超重和肥胖的糖尿病患者选择降糖药物时应当综合考虑药物对体重的影响,并尽量减少增加体重的降糖药物,部分患者可考虑应用减重药物。
1.具有减重作用的降糖药:具有不同程度减重效果的降糖药物包括二甲双胍、α-糖苷酶抑制剂、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、胰高糖素样肽-1受体激动剂(GLP-1RA)。对体重指数(BMI)≥27 kg/m2的T2DM患者,可在生活方式干预的基础上使用GLP-1RA等药物。
2.减重药:美国食品药品监督管理局(FDA)批准了在饮食、运动、行为疗法基础上辅助体重管理的药物。这类药物也可能对T2DM患者的血糖控制有改善作用,并能延迟糖尿病高危人群发展为T2DM[
手术治疗参见T2DM患者的代谢手术章节。
1.代谢手术需要多学科协作,进行术前、术中及术后的全程管理。(C)
2.代谢手术后患者应定期监测微量营养素和评估营养状态。(C)
肥胖的成人T2DM患者尽量采取生活方式及药物治疗,血糖仍然控制不佳者可考虑代谢手术治疗。代谢手术治疗可以明显改善肥胖T2DM患者的血糖控制,其中部分患者的糖尿病可达到“缓解”状态。来自国内的研究结果显示,手术1年后糖尿病缓解率可达73.5%[
建议代谢手术在由内分泌科、普外科、麻醉科等相关科室共同组成的多学科协作团队中进行。为了获得更好的手术获益,需严格掌握手术适应证和禁忌证,加强围手术期及远期并发症的预防,预防术后宏量及微量营养素摄入不足或不均衡。代谢手术的综合管理应由内分泌科和外科医师共同完成[
年龄在18~60岁,一般状况较好,手术风险较低,经生活方式干预和各种药物治疗难以控制的T2DM[糖化血红蛋白(HbA1c)>7.0%]或伴发疾病,并符合以下条件,可考虑代谢手术治疗[
1.可选适应证:BMI≥32.5 kg/m2,有或无合并症的T2DM,可行代谢手术[
2.慎选适应证:27.5 kg/m2≤BMI<32.5 kg/m2且有T2DM,尤其存在其他心血管风险因素时,可慎重选择代谢手术[
3.暂不推荐:BMI≤27.5 kg/m2,暂不推荐手术治疗。25.0 kg/m2≤BMI<27.5 kg/m2的T2DM患者,合并有中心型肥胖(腰围男性≥90 cm,女性≥85 cm),且至少有高甘油三酯、高低密度脂蛋白胆固醇、高血压中的2项代谢综合征组分,手术可在患者知情同意下,严格按研究方案进行。这些手术的性质应被视为临床研究,事先应有医学伦理委员会批准;由于目前临床获益证据不足,暂不推荐作为临床常规治疗方法。
1.滥用药物、酒精成瘾、患有难以控制的精神疾病患者,以及对代谢手术的风险、获益、预期后果缺乏理解能力的患者。
2. 1型糖尿病患者。
3.胰岛β细胞功能已明显衰竭的T2DM患者。
4.有手术禁忌证者。
5. BMI<25 kg/m2。
6.妊娠期糖尿病(GDM)及其他特殊类型的糖尿病。
代谢手术常用手术方式包括腹腔镜下胃袖状切除术、腹腔镜下Roux-en-Y胃旁路术和胆胰转流十二指肠转位术。
1.胃袖状切除术:切除约80%的胃,留下“袖管”样的长管状胃通道,食物摄取受限。手术后2年T2DM平均缓解率为70%。手术不改变人体消化道结构,不产生营养物质缺乏,手术操作相对简单,术后并发症较少,并发症发病率及再次手术率是所有代谢手术中最低的[
2.胃旁路术:这一术式旷置了远端胃大部、十二指肠和部分空肠,既限制胃容量又减少营养吸收,使肠-胰岛轴功能恢复正常。随访5年,T2DM缓解率为83%。该术式操作较为复杂,创伤大,并发症发生率高,术后需监测与补充营养物质。用于T2DM病程相对较长需要减重更多的患者[
3.胆胰旁路术:虽然减重效果好,T2DM缓解率可达95%,但手术操作极为复杂,并发症和死亡率均较高,容易出现维生素、微量元素、营养物质(特别是蛋白质)缺乏,术后必须严格监控营养代谢紊乱状况,并予以补充。对于BMI≥50 kg/m2的严重肥胖伴T2DM患者可以选择胆胰转流十二指肠转位术。目前临床上较少使用。
术后仅用生活方式治疗可使HbA1c≤6.5%,空腹血糖≤5.6 mmol/L,可视为T2DM缓解[
手术治疗肥胖伴T2DM有一定的短期和长期风险,该治疗方法的长期有效性和安全性,特别是在我国人群中的有效性和安全性尚有待评估。多项Meta分析显示,胃旁路术后30 d死亡率为0.3%~0.5%,90 d死亡率为0.35%。深静脉血栓形成和肺栓塞是手术引起死亡的重要原因。术后并发症还包括出血、吻合口瘘、消化道梗阻、溃疡等。远期并发症包括营养缺乏、胆石症、内疝形成等。建议卫生行政主管部门设立该类手术的资格准入制度,以保证手术的有效性和安全性。我国尚缺少手术治疗与药物治疗的随机对照研究,特别是以并发症为终点的前瞻性研究。
1.术前筛选及评估:由具有内分泌专业知识的内科医师对内科治疗效果不佳的糖尿病患者进行筛选,并对具有代谢手术适应证的患者进行术前评估。
术前评估应包括以下六要素:
(1)明确诊断与评估:肥胖病因、体重与BMI、减重病史、肥胖相关合并症、主观减重意愿、排除手术风险大的人群、内分泌功能评估与实验室检测。
(2)常规实验室检查:糖代谢(空腹血糖、餐后2 h血糖、HbA1c、C肽)、血脂、肝功能、肾功能、尿常规、血常规、促凝血试验、营养评估(铁、维生素B12、叶酸、维生素D3等)。
(3)心肺功能评估:睡眠呼吸暂停监测、肺功能监测、24 h动态心电图和动态血压监测、超声心动图、胸部X线片等。
(4)消化系统评估:检测幽门螺杆菌、肝胆B超检查有无胆石症、上消化道内镜检查排除肿瘤等。
(5)神经及精神系统评估:食欲与行为、精神疾患(抑郁症等)。
(6)术前努力减重,积极控制血糖,戒烟、手术前后怀孕指导(针对育龄女性)、手术费用知情指导等。
2.术后管理:包括以下内容:(1)术后膳食管理,限制总热量,采用渐进式的阶段饮食,清流质约1周,流质约1个月、软质、固体食物。进食速度放慢,每餐进食约30 min;少食多餐,细嚼慢咽,以防止胃出口梗阻、呕吐;循序渐进,达到每日建议的总热量。推荐每日摄入足够水分,保证每日蛋白质摄入量,酌情补充多种维生素与微量元素,定期随访监测微量元素水平。(2)术后饮食禁忌。避免食用浓缩的甜食,包括饮料、点心,防止出现倾倒综合征;避免油炸和不易消化的食物;避免在进餐时喝汤和喝水,可在两餐之间或餐后45 min再摄入汤水;避免在3个月内摄取冰水、咖啡、茶类、酒精等刺激物。
1.血糖监测是糖尿病管理中的重要组成部分,其结果有助于评估糖尿病患者糖代谢紊乱的程度,制定合理的降糖方案,反映降糖治疗的效果并指导治疗方案的调整。(A)
2.临床上血糖监测方法包括毛细血管血糖监测、CGM、HbA1c和GA。(A)
3. TIR应纳入血糖控制目标。(B)
目前临床上的血糖监测方法包括利用血糖仪进行的毛细血管血糖监测、持续葡萄糖监测(CGM)、糖化血红蛋白(HbA1c)和糖化白蛋白(GA)的检测等。其中毛细血管血糖监测包括患者自我血糖监测(SMBG)及在医院内进行的床边快速血糖检测[
SMBG是糖尿病综合管理和教育的组成部分,建议所有糖尿病患者均需进行SMBG。不同监测时间点的适用范围见


1.采用生活方式干预控制糖尿病的患者,可根据需要有目的地通过血糖监测了解饮食控制和运动对血糖的影响,从而调整饮食和运动方案。
2.使用口服降糖药者可每周监测2~4次空腹或餐后2 h血糖。
3.使用胰岛素治疗者可根据胰岛素治疗方案进行相应的血糖监测。使用基础胰岛素的患者应监测空腹血糖,根据空腹血糖调整睡前胰岛素的剂量;使用预混胰岛素者应监测空腹和晚餐前血糖,根据空腹血糖调整晚餐前胰岛素剂量,根据晚餐前血糖调整早餐前胰岛素剂量,空腹血糖达标后,注意监测餐后血糖以优化治疗方案。
4.特殊人群[围手术期患者、低血糖高危人群、危重症患者、老年患者、1型糖尿病(T1DM)患者]的监测,应遵循以上血糖监测的基本原则,实行个体化的监测方案。
HbA1c在临床上已作为评估长期血糖控制状况的“金标准”,也是临床决定是否需要调整治疗的重要依据。标准的HbA1c检测方法的正常参考值为4%~6%,在治疗之初建议每3个月检测1次,一旦达到治疗目标可每6个月检查1次。对于患有贫血和血红蛋白异常疾病的患者,HbA1c的检测结果是不可靠的。
GA能反映糖尿病患者检测前2~3周的平均血糖水平,其正常参考值为11%~17%[
CGM是指通过葡萄糖传感器连续监测皮下组织间液的葡萄糖浓度变化的技术,可以提供更全面的血糖信息,了解血糖变化的特点。CGM包括回顾性CGM系统、实时CGM系统[
1. T1DM。
2.需要胰岛素强化治疗的2型糖尿病(T2DM)患者。
3.在SMBG指导下使用降糖治疗的T2DM患者,仍出现下列情况之一,具体包括:(1)无法解释的严重低血糖或反复低血糖,无症状性低血糖、夜间低血糖;(2)无法解释的高血糖,特别是空腹高血糖;(3)血糖波动大;(4)出于对低血糖的恐惧,刻意保持高血糖状态的患者。
4.妊娠期糖尿病(GDM)或糖尿病合并妊娠。
5.患者教育。
有研究表明,血清1,5-脱水葡萄糖醇(1,5-AG)可反映既往1~2周的平均血糖水平,可作为辅助的血糖监测指标用于糖尿病筛查及指导治疗方案的调整[
新指标葡萄糖目标范围内时间(TIR)或称葡萄糖达标时间百分比,是指24 h内葡萄糖在目标范围内(通常为3.9~10.0 mmol/L)的时间(用min表示)或其所占的百分比,可由CGM数据或SMBG数据(至少每日7次血糖监测)计算[
胰岛素治疗是糖尿病管理中不可或缺的组成部分,胰岛素注射技术是实施胰岛素治疗的基础。全球注射技术调研结果显示,缺乏注射技术教育、对注射技术掌握不够是血糖控制不佳的重要原因之一,也容易引起皮下脂肪增生、疼痛等多种并发症。接受与胰岛素注射相关的教育,可使广大患者受益。胰岛素注射的教育内容包括心理调节、注射治疗的方案、注射装置的选择及管理、注射部位的选择、护理及自我检查、正确的注射技术、注射相关并发症及其预防、选择合适长度的针头、针头使用后的安全处置。
目前主要的胰岛素注射装置包括胰岛素注射笔(胰岛素笔或特充装置)、胰岛素注射器及胰岛素泵。在为患者选择胰岛素注射装置时,应综合考虑患者的个人需求、实际情况和各种注射装置的优缺点,进行个体化选择。此外,还需要通过合适长度的针头将药物输送至皮下组织内。
腹部、大腿外侧、上臂外侧和臀部外上侧是人体适合注射胰岛素的部位。当皮肤表面到肌肉的距离小于或等于针头长度时,需要捏皮或调整注射角度,以提高注射安全性。胰岛素注射可能会出现脂肪增生、脂肪萎缩、疼痛、出血、淤血和特发性皮肤色素沉着等并发症,为了尽可能减少并发症的发生,需定期轮换注射部位,包括不同注射部位之间的轮换和同一注射部位内的轮换,以及避免针头重复使用[
胰岛素泵适用于T1DM患者、需要胰岛素泵治疗的T2DM及其他类型糖尿病患者。(A)
本节提到的胰岛素泵治疗是指持续皮下胰岛素输注(CSII),即采用人工智能控制的胰岛素输入装置,通过持续皮下输注的一种胰岛素给药方式;这种方式可以最大程度地模拟人体生理性胰岛素分泌模式,从而达到更好控制血糖的目的。
经典的胰岛素泵由4个部分构成:含有微电子芯片的人工智能控制系统、电池驱动的机械泵系统、储药器、与之相连的输液管和可埋入患者皮下的输注装置。在工作状态下,泵的机械系统接收控制系统的指令,驱动储药器后端贴紧的活塞,将胰岛素通过与储药器连接的输液管输入皮下,然后经血液吸收发挥降糖作用。随着新技术的发展,除了经典的胰岛素泵以外,含有CGM的胰岛素泵(SAP或3C)、混合闭环胰岛素泵、贴敷式胰岛素泵以及具有低血糖暂停功能和预测低血糖暂停功能的胰岛素泵等新型的胰岛素泵相继问世,有助于进一步优化血糖控制[
作为一种CSII装置,胰岛素泵原则上适用于所有需要应用胰岛素治疗的糖尿病患者,主要包括T1DM患者、计划受孕和已孕的糖尿病妇女或需要胰岛素治疗的GDM患者、需要胰岛素强化治疗的T2DM患者,需要长期胰岛素替代治疗的其他类型糖尿病(如胰腺切除术后等)。
1.T1DM:对于每日多次皮下注射胰岛素的T1DM患者,如血糖控制不佳,可以考虑改用CSII。在老年T1DM患者CSII同样具有良好的降糖效果,并能减少低血糖发生[
2.妊娠患者:GDM、糖尿病合并妊娠及糖尿病患者做孕前准备时均可使用CSII。妊娠期间使用CSII治疗可以减少胰岛素用量,使母亲体重增加更少,改善HbA1c[
3. T2DM:在T2DM患者中,长期CSII治疗主要用于糖尿病病程较长、血糖波动大,虽每日多次胰岛素皮下注射,血糖仍无法得到平稳控制者;黎明现象严重导致血糖总体控制不佳者;频发低血糖,尤其是夜间低血糖、无感知低血糖和严重低血糖者。
4. T2DM患者的短期胰岛素强化治疗:对于下列患者,CSII是短期胰岛素强化治疗最有效的方法之一。包括HbA1c≥9.0%或空腹血糖≥11.1 mmol/L,或伴明显高血糖症状的新诊断T2DM患者;具有一定病程,已经使用两种或两种以上口服降糖药联合治疗但血糖仍明显升高(HbA1c≥9.0%),或已起始胰岛素治疗且经过充分的剂量调整血糖仍未达标(HbA1c≥7.0%)者,可实施短期胰岛素强化治疗,而对于新诊断T2DM患者,采用短期CSII强化治疗,有助于解除患者的高糖毒性,恢复其胰岛功能,达到临床缓解,有学者报道1年的临床缓解率约为50%[
5.围手术期:短期CSII可用于围手术期患者,围手术期糖尿病患者使用CSII治疗后,相比使用胰岛素皮下注射者,不仅血糖控制更好,同时能显著降低术后感染率、促进伤口愈合、缩短住院时间。
使用CSII前,首先要根据患者的具体情况确定每日的胰岛素总量。对此前未接受过胰岛素治疗的T2DM患者,初始剂量通常根据以下公式计算,每日总量(U)=体重(kg)×(0.2~0.4 U/kg);已接受胰岛素治疗的T2DM患者,每日总量=用泵前每日胰岛素用量×80%,可以根据病情酌情增减。一般而言,基础输注量占全天胰岛素总量的40%~60%,可以按需将24 h分为若干个时间段,分别设置不同的输注速率。餐前大剂量通常按照1/3、1/3、1/3分配。带泵初期应严密监测血糖,根据血糖变化调节胰岛素泵的设置,包括基础输注量和各个时间段的输注率以及餐前大剂量。
1.酮体的检测推荐采用血酮,若不能检测血酮,尿酮检测可作为备用。血酮体≥3 mmoL/L或尿酮体阳性(++以上)为DKA诊断的重要标准之一。(B)
2.补液是首要治疗措施,推荐首选生理盐水。原则上先快后慢,第1小时输入生理盐水,速度为15~20 ml·kg??·h??(一般成人1.0~1.5 L)。随后的补液速度需根据患者脱水程度、电解质水平、尿量、心功能、肾功能等调整。推荐在第1个24 h内补足预先估计的液体丢失量。(A)
3.胰岛素治疗推荐采用连续静脉输注(0.1 U·kg??·h??);重症患者可采用首剂静脉注射胰岛素0.1 U/kg,随后以0.1 U·kg??·h??速度持续输注。(A)
4.治疗过程中需监测血糖、血酮或尿酮,并根据血糖水平或血糖下降速度调整胰岛素用量。(B)
5.血钾<5.2 mmol/L并有足够尿量(>40 ml/h)时即开始补钾。(B)
6.严重酸中毒(pH≤6.9)需适当补充碳酸氢钠液。(B)
糖尿病酮症酸中毒(DKA)是由于胰岛素不足和升糖激素不适当升高引起的糖、脂肪和蛋白质代谢严重紊乱综合征,临床以高血糖、高血酮和代谢性酸中毒为主要特征。1型糖尿病(T1DM)有发生DKA的倾向;2型糖尿病(T2DM)亦可发生DKA。DKA的发生常有诱因,包括急性感染、胰岛素不适当减量或突然中断治疗、饮食不当、胃肠疾病、脑卒中、心肌梗死、创伤、手术、妊娠、分娩、精神刺激等。
DKA分为轻度、中度和重度。仅有酮症而无酸中毒称为糖尿病酮症;轻、中度DKA除酮症外,还有轻~中度酸中毒;重度DKA是指酸中毒伴意识障碍(DKA昏迷),或虽无意识障碍,但血清HCO低于10 mmol/L。
DKA常呈急性起病。在DKA起病前数天可有多尿、烦渴多饮和乏力症状的加重,失代偿阶段出现食欲减退、恶心、呕吐、腹痛,常伴头痛、烦躁、嗜睡等症状,呼吸深快,呼气中有烂苹果味(丙酮气味);病情进一步发展,出现严重失水现象,尿量减少、皮肤黏膜干燥、眼球下陷,脉快而弱,血压下降、四肢厥冷;到晚期,各种反射迟钝甚至消失,终至昏迷。
首要的实验室检查应包括:血常规、血糖、血尿素氮、血肌酐、血酮体、血电解质、血渗透压、血气分析、尿常规、尿酮体等。若怀疑合并感染还应进行血、尿和咽部的细菌培养[
如血酮体升高(血酮体≥3 mmol/L)或尿糖和酮体阳性(++以上)伴血糖增高(血糖>13.9 mmol/L),血pH(pH<7.3)和(或)二氧化碳结合力降低(HCO<18 mmol/L),无论有无糖尿病病史,都可诊断为DKA。诊断标准见

DKA的治疗原则为尽快补液以恢复血容量、纠正失水状态,降低血糖,纠正电解质及酸碱平衡失调,同时积极寻找和消除诱因,防治并发症,降低病死率。对无酸中毒的糖尿病酮症患者,需适当补充液体和胰岛素治疗,直到酮体消失。DKA应按以下方法积极治疗[
1.补液:能纠正失水,恢复血容量和肾灌注,有助于降低血糖和清除酮体。治疗中补液速度应先快后慢,第1小时输入生理盐水,速度为15~20 ml·kg??·h??(一般成人1.0~1.5 L)。随后补液速度取决于脱水程度、电解质水平、尿量等。要在第1个24 h内补足预先估计的液体丢失量,补液治疗是否奏效,要看血流动力学(如血压)、出入量、实验室指标及临床表现。对有心、肾功能不全者,在补液过程中要监测血浆渗透压,并经常对患者的心脏、肾脏、神经系统状况进行评估以防止补液过快。
在DKA治疗过程中,纠正高血糖的速度一般快于酮症,血糖降至13.9 mmol/L、DKA得到纠正(pH>7.3,HCO>18.0 mmol/L)的时间分别约为6 h和12 h[
2.胰岛素:皮下注射速效胰岛素与静脉注射胰岛素在轻~中度的DKA患者的预后方面无明显差异,但越来越多的证据已推荐将小剂量胰岛素连续静脉滴注方案作为DKA的标准治疗,本指南推荐采用连续胰岛素静脉输注(0.1 U·kg??·h??),但对于重症患者,可采用首剂静脉注射胰岛素0.1 U/kg,随后以0.1 U·kg??·h??速度持续输注,胰岛素静脉输注过程中需严密监测血糖,根据血糖下降速度调整输液速度以保持血糖每小时下降2.8~4.2 mmol/L。若第1小时内血糖下降不足10%,或有条件监测血酮时,血酮下降速度<0.5 mmol·L??·h??,且脱水已基本纠正,则增加胰岛素剂量1 U/h[
当DKA患者血糖降至11.1 mmol/L时,应减少胰岛素输入量至0.02~0.05 U·kg??·h??[
3.纠正电解质紊乱:在开始胰岛素及补液治疗后,若患者的尿量正常,血钾<5.2 mmol/L即应静脉补钾,一般在每升输入溶液中加氯化钾1.5~3.0 g,以维持血钾水平在4~5 mmol/L之间。治疗前已有低钾血症,尿量≥40 ml/h时,在补液和胰岛素治疗同时必须补钾。严重低钾血症可危及生命,若发现血钾<3.3 mmol/L,应优先进行补钾治疗,当血钾升至3.3 mmol/L时[
4.纠正酸中毒:DKA患者在注射胰岛素治疗后会抑制脂肪分解,进而纠正酸中毒,如无循环衰竭,一般无需额外补碱。但严重的代谢性酸中毒可能会引起心肌受损、脑血管扩张、严重的胃肠道并发症以及昏迷等严重并发症。推荐仅在pH≤6.9的患者考虑适当补碱治疗[
5.去除诱因和治疗并发症:如休克、感染、心力衰竭和心律失常、脑水肿和肾衰竭等。
治疗过程应准确记录液体入量及出量、血糖及血酮。
我国的研究结果显示,当随机血糖超过19.05 mmol/L(血清酮体≥3 mmol/L)时,可预警DKA[
1.补液是治疗HHS的首要措施,原则上先快后慢。(A)
2.补液首选0.9%氯化钠,当血糖下降至16.7 mmol/L时,需补充5%含糖液。(B)
3. HHS治疗中应适时评估有效血浆渗透压以监测治疗反应。(B)
高渗性高血糖状态(HHS)是糖尿病的严重急性并发症之一,临床以严重高血糖而无明显DKA、血浆渗透压显著升高、脱水和意识障碍为特征。
HHS起病隐匿,一般从开始发病到出现意识障碍需要1~2周,偶尔急性起病,约30%~40%无糖尿病病史[
HHS的实验室诊断参考标准是[
HHS病情危重、并发症多,病死率高于DKA,强调早期诊断和治疗。治疗原则同DKA,主要包括积极补液,纠正脱水;小剂量胰岛素静脉输注控制血糖;纠正水、电解质和酸碱失衡以及去除诱因和治疗并发症。
1.补液:HHS失水比DKA更严重,24 h总的补液量一般应为100~200 ml/kg[
2.胰岛素治疗:胰岛素使用原则与治疗DKA大致相同,一般来说HHS患者对胰岛素较为敏感,胰岛素用量相对较小。推荐以0.1 U·kg??·h??持续静脉输注。当血糖降至16.7 mmol/L时,应减慢胰岛素的滴注速度至0.02~0.05 U·kg??·h??,同时续以葡萄糖溶液静滴,并不断调整胰岛素用量和葡萄糖浓度,使血糖维持在13.9~16.7 mmoL/L,直至HHS高血糖危象缓解。HHS缓解主要表现为血渗透压水平降至正常、患者意识状态恢复正常[
3.补钾:HHS患者存在缺钾,补钾原则与DKA相同。
4.连续性肾脏替代治疗(CRRT):早期给予CRRT治疗,能有效减少并发症的出现,减少住院时间,降低患者病死率,其机制为CRRT可以平稳有效地补充水分和降低血浆渗透压。另外,CRRT可清除循环中的炎性介质、内毒素,减少多器官功能障碍综合征等严重并发症的发生。但CRRT治疗HHS仍是相对较新的治疗方案,还需要更多的研究以明确CRRT的治疗预后。
5.其他治疗:包括去除诱因,纠正休克,防治低血糖和脑水肿、预防压疮等。
1.糖尿病患者常伴有高血压、血脂紊乱等心血管疾病的重要危险因素。(A)
2.糖尿病患者至少应每年评估心血管疾病的风险因素。(B)
3.对多重危险因素的综合控制可显著改善糖尿病患者心脑血管疾病和死亡风险。(A)
4. GLP-1RA和SGLT2i能够改善ASCVD。(A)
糖尿病患者的心血管疾病主要包括动脉粥样硬化性心血管疾病(ASCVD)和心力衰竭,其中ASCVD包括冠心病、脑血管疾病和周围血管疾病,糖尿病患者的心血管疾病也是糖尿病患者的主要死亡原因。糖尿病是心血管疾病的独立危险因素,糖尿病患者常常合并高血压、血脂紊乱等心血管疾病的重要危险因素[
糖尿病患者的心力衰竭住院风险增加2倍,糖尿病患者可以出现射血分数保留的心力衰竭和射血分数下降的心力衰竭。高血压和ASCVD常与两种不同类型的心力衰竭共存,既往有心肌梗死更易发生射血分数下降的心力衰竭[
因此,对糖尿病患者的心血管疾病预防,需要针对所有患者每年进行危险因素筛查,包括超重与肥胖、高血压、血脂紊乱、吸烟、冠心病家族史、慢性肾病、白蛋白尿等。目前,我国T2DM患者的心血管危险因素发生率高,但控制率较低。在T2DM患者中,血糖、血压和血脂控制综合达标率仅为5.6%[
糖尿病确诊时及以后,至少应每年评估心血管疾病的风险因素,评估的内容包括心血管病史、年龄、吸烟、高血压、血脂紊乱、肥胖特别是腹型肥胖、早发心血管疾病的家族史、肾脏损害(尿白蛋白排泄率增高等)、心房颤动(可导致卒中)。可以采用中国缺血性心血管疾病风险评估模型和Framingham风险评估模型评估10年心血管疾病风险。静息时的心电图检查对T2DM患者心血管疾病的筛查价值有限。
1.糖尿病患者的血压控制目标应个体化,一般糖尿病患者合并高血压,降压目标为<130/80 mmHg(1 mmHg=0.133 kPa)。(B)
2.老年或伴严重冠心病的糖尿病患者,可确定相对宽松的降压目标值。(B)
3.糖尿病孕妇合并高血压,建议血压控制目标为≤135/85 mmHg。(B)
4.糖尿病患者的血压水平>120/80 mmHg即应开始生活方式干预以预防高血压的发生。(B)
5.糖尿病患者的血压≥140/90 mmHg可考虑开始降压药物治疗。血压≥160/100 mmHg或高于目标值20/10 mmHg时应立即开始降压药物治疗,并应用联合治疗方案。(A)
6.五类降压药物(ACEI、ARB、钙通道阻滞剂、利尿剂、选择性β受体阻滞剂)均可用于糖尿病合并高血压患者。(A)
我国T2DM患者中约60%伴有高血压[
糖尿病患者首次就诊时及随访过程中应常规测量血压,应推荐糖尿病患者监测家庭血压,以提高糖尿病患者的高血压知晓率、治疗率与控制率。当诊室血压测量确诊高血压后,鉴于糖尿病患者易出现夜间血压增高和清晨高血压现象,建议患者进行家庭血压测量和必要时24 h动态血压监测,便于有效地进行血压管理。
生活方式干预是控制高血压的重要措施,主要包括健康教育、减少钠盐摄入、增加钾摄入、合理膳食、控制体重、不吸烟、不饮酒、增加运动、减轻精神压力、保持心理平衡等[
对糖尿病患者血压增高的初始干预方案应视血压水平而定。糖尿病患者的血压水平如果超过120/80 mmHg(1 mmHg=0.133 kPa)即应开始生活方式干预以预防高血压的发生。血压≥140/90 mmHg者可考虑开始降压药物治疗[
对于糖尿病患者的血压控制目标,目前国内外指南[
降压药物选择时应综合考虑降压疗效、对心脑肾的保护作用、安全性和依从性以及对代谢的影响等因素。糖尿病患者降压治疗的获益主要与血压控制本身有关。由于糖尿病患者易出现夜间血压升高,可在24 h动态血压评估的基础上指导及调整药物使用,必要时可考虑睡前服药。优选长效制剂有效平稳控制24 h血压(包括夜间血压与晨峰血压),以减少血压昼夜波动,预防心脑血管事件发生。五类降压药物分别为血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、钙通道阻滞剂、利尿剂和选择性β受体阻滞剂,均可用于糖尿病患者,其中ACEI或ARB在糖尿病合并白蛋白尿或慢性肾脏病时为首选药物[
1.将降低LDL-C作为首要目标,依据患者ASCVD危险高低,将LDL-C降至目标值。(A)
2.临床首选他汀类调脂药物。(A)
3.起始宜应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量,若胆固醇水平不能达标,可联合其他调脂药物。(B)
4. ASCVD高危、极高危患者现有调脂药物标准治疗3个月后,难以使LDL-C降至所需目标值,则可考虑将LDL-C较基线降低50%作为替代目标。(B)
5.如果空腹TG>5.7 mmol/L,为预防急性胰腺炎,首先使用降低TG的药物。(C)
6.每年行血脂监测,药物治疗期间需定期监测血脂变化。(C)
T2DM患者的血脂异常主要表现为血甘油三酯(TG)、极低密度脂蛋白、游离脂肪酸水平升高,高密度脂蛋白胆固醇(HDL-C)水平下降,持续性餐后高脂血症以及低密度脂蛋白胆固醇(LDL-C)水平轻度升高,小而密的低密度脂蛋白和小而密的高密度脂蛋白均增加。这些血脂异常是引起糖尿病血管病变的重要危险因素[
降低总胆固醇和LDL-C水平可显著降低糖尿病患者大血管病变和死亡风险,是糖尿病调脂治疗的主要目标,非HDL-C是次要干预靶点。对有ASCVD高风险的T2DM人群,在他汀类药物治疗的基础上,若仍有TG升高和(或)HDL-C降低,联用其他调脂药物,有可能进一步降低糖尿病患者发生心血管事件及其死亡风险[
心血管危险分层:(1)高危:无ASCVD的糖尿病患者;(2)极高危:有明确ASCVD病史的糖尿病患者。ASCVD病史包括既往心肌梗死或不稳定型心绞痛、稳定型心绞痛、冠状动脉血运重建术后、卒中和短暂性脑缺血发作以及外周动脉疾病。
糖尿病患者每年至少应检查1次血脂(包括总胆固醇、TG、LDL-C、HDL-C)。接受调脂药物治疗者,4~12周后检查患者的依从性和生活方式、血脂改变的情况,通过复查血脂了解患者对降脂药的反应,及早发现药物的不良反应,根据需要每3~12个月重复1次。
要求患者保持健康生活方式,是维持合适血脂水平和控制血脂紊乱的重要措施,主要包括减少饱和脂肪酸、反式脂肪酸和胆固醇的摄入;增加n-3脂肪酸的摄入;减轻体重;增加运动及戒烟、限酒等[61]。
进行调脂药物治疗时,推荐将降低LDL-C作为治疗目标。依据患者ASCVD风险等级,推荐将LDL-C降至目标值(
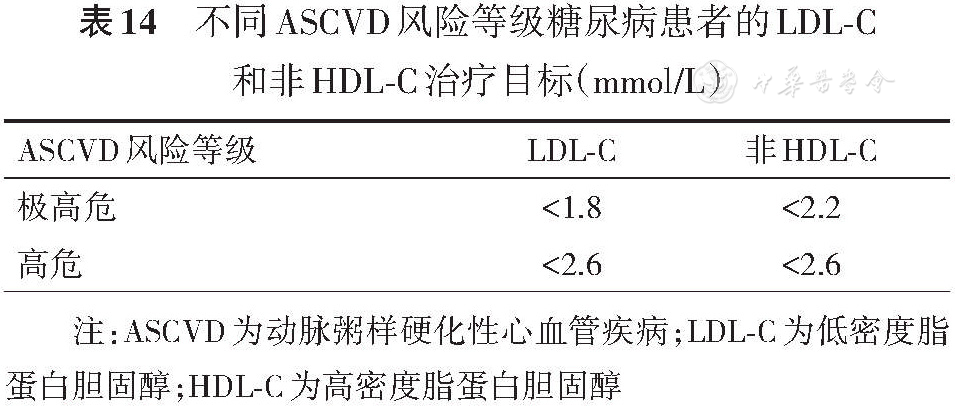
起始宜应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量。若胆固醇水平不能达标,与其他调脂药物联合使用(如依折麦布),针对极高危患者若他汀联合依折麦布4~6周后仍不达标,可加用前蛋白转化酶枯草溶菌素/kexin 9型抑制剂,能获得安全有效的调脂效果,可进一步降低心血管风险[
如果LDL-C基线值较高,现有调脂药物标准治疗3个月后,难以使LDL-C降至所需目标值,则可考虑将LDL-C至少降低50%以上作为替代目标。基线是指未接受降脂药物治疗时的LDL-C水平,而正在接受降脂治疗的患者中,则外推计算基线的LDL-C水平[
LDL-C达标后,若TG仍高,可在他汀治疗的基础上加用降低TG药物(如贝特类)。如果空腹TG≥5.7 mmol/L,为预防急性胰腺炎,首先使用降低TG的药物。
1.糖尿病患者合并ASCVD需应用阿司匹林(75~150 mg/d)作为二级预防,同时需要充分评估出血风险。(A)
2.对阿司匹林过敏的患者,需应用氯吡格雷(75 mg/d)作为二级预防。(B)
3.阿司匹林(75~150 mg/d)作为一级预防用于糖尿病合并ASCVD高危患者的适应证为年龄≥50岁而且合并至少1项主要危险因素(早发ASCVD家族史、高血压、血脂异常、吸烟或慢性肾脏病/蛋白尿),无出血高风险。(C)
阿司匹林对心血管事件二级预防的有效性已有共识,早期医生健康研究和女性健康研究等一级预防试验结果显示,阿司匹林对高风险患者有低到中等程度获益,但2018年发表的糖尿病心血管事件研究(ASCEND)、阿司匹林降低初始血管事件研究(ARRIVE)以及阿司匹林降低老年人事件研究(ASPREE)表明,阿司匹林在一级预防中心血管获益较小,且可能增加出血风险,提示阿司匹林对于糖尿病患者心血管事件一级预防的使用应慎重[
1.在低危和中危患者中的应用:不推荐在ASCVD低危患者(如<50岁患者,糖尿病不伴有ASCVD危险因素)中应用阿司匹林,因其有限获益可能会被出血风险抵消[
2.阿司匹林应用的合适剂量:在包括糖尿病患者的大多数临床研究中,阿司匹林的平均剂量为50~650 mg/d,但集中在100~325 mg/d范围。鲜有证据支持某一特定剂量,但用最低剂量会有助于减少不良反应[
3.P2Y12受体拮抗剂应用指征:阿司匹林过敏的ASCVD患者,需应用氯吡格雷(75 mg/d)作为二级预防[
1.推荐所有T2DM患者每年至少进行1次UACR和血肌酐测定(计算eGFR)。(B)
2.有效的降糖治疗、血压控制可延缓糖尿病肾病的发生和进展。(A)
3.对糖尿病伴高血压且UACR>300 mg/g或eGFR<60 ml·min??·(1.73 m?)??的糖尿病患者,首选ACEI或ARB类药物治疗。(A)
4.对伴高血压且UACR为30~300 mg/g的糖尿病患者,推荐首选ACEI或ARB类药物治疗。(B)
5.对伴糖尿病肾病的T2DM患者,推荐在eGFR≥45 ml·min??·(1.73 m?)??的患者中使用SGLT2i,以降低糖尿病肾病进展和(或)心血管事件的风险。(A)
6.使用GLP-1RA能够降低新发大量白蛋白尿的风险,可考虑在eGFR≥30 ml·min??·(1.73 m?)??的患者中使用。(C)
7.推荐糖尿病肾病患者蛋白摄入量为0.8 g·kg??·d??,开始透析者蛋白摄入量可适当增加。(B)
8.对eGFR<30 ml·min??·(1.73 m?)??的糖尿病肾病患者,应由肾脏科医师评估是否应当接受肾脏替代治疗。(A)
慢性肾脏病(CKD)包括各种原因引起的慢性肾脏结构和功能障碍。糖尿病肾病是指由糖尿病所致的CKD,病变可累及全肾(包括肾小球、肾小管、肾间质等)[
2型糖尿病(T2DM)患者在诊断时即应进行肾脏病变的筛查,以后每年应至少筛查1次,包括尿常规、尿白蛋白/肌酐比值(UACR)和血肌酐(计算eGFR)。这种筛查方式有助于发现早期肾脏损伤,并鉴别其他一些常见的非糖尿病性肾病。1型糖尿病(T1DM)患者一般5年后才会发生糖尿病肾病,T2DM患者在诊断时即可伴有糖尿病肾病[
糖尿病肾病常常是根据持续存在的UACR增高和(或)eGFR下降、同时排除其他CKD而做出的临床诊断。以下情况应考虑非糖尿病肾病并及时转诊至肾脏科,包括:(1)活动性尿沉渣异常(血尿、蛋白尿伴血尿、管型尿);(2)短期内eGFR迅速下降;(3)不伴糖尿病视网膜病变(DR,特别是T1DM);(4)短期内UACR迅速增高或出现肾病综合征。DR并非诊断T2DM患者糖尿病肾病的必备条件。病理诊断为糖尿病肾病的金标准,病因难以鉴别时可行肾穿刺病理检查,但不推荐糖尿病患者常规行肾脏穿刺活检。
推荐采用随机尿测定UACR。24 h尿白蛋白定量与UACR诊断价值相当,但前者操作较为繁琐。单独测量随机尿标本的白蛋白水平而不同时测量尿肌酐的做法较便宜,但由于水化引起的尿液浓度变化,容易造成结果的假阴性和假阳性。随机尿UACR≥30 mg/g为尿白蛋白排泄增加。在3~6个月内重复检查UACR,3次中有2次尿白蛋白排泄增加,排除感染等因素即可诊断白蛋白尿。临床上常将UACR 30~300 mg/g称为微量白蛋白尿,UACR>300 mg/g称为大量白蛋白尿。UACR升高与eGFR下降、心血管事件、死亡风险增加密切相关。UACR测定存在较多影响因素,如感染、发热、显著高血糖、未控制的高血压、24 h内运动、心力衰竭、月经等,结果分析时应考虑这些因素。
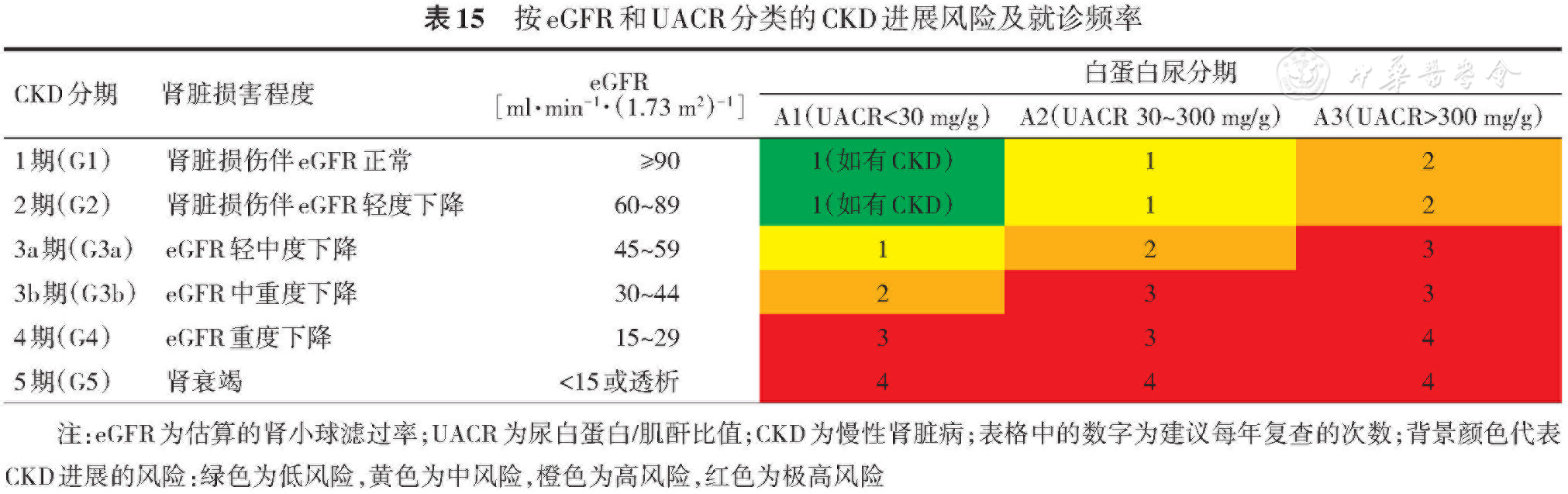
推荐测定血清肌酐,使用慢性肾脏病流行病学合作研究(CKD-EPI)或肾脏病膳食改良试验(MDRD)公式计算eGFR(参考
糖尿病肾病诊断确定后,应根据eGFR进一步判断CKD严重程度。肾脏病改善全球预后指南(KDIGO)建议联合CKD分期和白蛋白尿分期评估糖尿病肾病的进展风险及复查频率(
建议对糖尿病肾病患者进行包含不良生活方式调整、危险因素(高血糖、高血压、脂代谢紊乱等)控制及糖尿病教育在内的综合管理,以降低糖尿病患者的肾脏不良事件和死亡风险[
1.改变不良生活方式:如合理控制体重、糖尿病饮食、戒烟及适当运动等。
2.营养:对未开始透析的糖尿病肾病患者,推荐蛋白摄入量为0.8 g·kg??·d??。过高的蛋白摄入(如>1.3 g·kg??·d??)与蛋白尿增加、肾功能下降、心血管及死亡风险增加有关,低于0.8 g·kg??·d??的蛋白摄入并不能延缓糖尿病肾病进展。对已开始透析的患者蛋白摄入量可适当增加,以免出现营养不良。我国T2DM伴白蛋白尿患者维生素D水平较低,补充维生素D可降低UACR,但能否延缓糖尿病肾病进展尚无证据[
3.控制血糖:有效的降糖治疗可延缓糖尿病肾病的发生和进展,推荐所有糖尿病肾病患者进行合理的降糖治疗。多项研究结果显示,钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)有降糖之外的肾脏保护作用。对伴糖尿病肾病的T2DM患者,推荐在eGFR≥45 ml·min??·(1.73 m?)??的患者中使用SGLT2i,以降低糖尿病肾病进展和(或)心血管事件的风险[99, 113,
4.控制血压:合理的降压治疗可延缓糖尿病肾病的发生和进展。推荐>18岁的非妊娠糖尿病患者血压应控制在130/80 mmHg(1 mmHg=0.133 kPa)以下[
对糖尿病伴高血压且UACR>300 mg/g或eGFR<60 ml·min??·(1.73 m?)??的患者,强烈推荐血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)类药物治疗。对于这类患者,ACEI或ARB类药物不仅减少心血管事件,而且延缓肾病进展,包括终末期肾病的发生[
对不伴高血压、尿UACR和eGFR正常的糖尿病患者,ACEI或ARB不能延缓肾病进展[
醛固酮受体拮抗剂可降低尿白蛋白、延缓eGFR下降,但存在升高血钾风险,且是否有肾脏终点事件获益尚需进一步验证[
5.纠正血脂异常:见血脂异常相关章节。
6.透析治疗和移植:当eGFR<60 ml·min??·(1.73 m?)??时,应评估并治疗潜在的CKD并发症;当<30 ml·min??·(1.73 m?)??时,应积极咨询肾脏专科医师,评估是否应当接受肾脏替代治疗。透析方式包括腹膜透析和血液透析,有条件的患者可行肾移植。
1.随访:所有患者需每年检查UACR、血清肌酐、血钾水平。3~4期的患者需密切随访CKD相关的代谢紊乱,如维生素D、血红蛋白、碳酸氢盐、钙磷代谢、甲状旁腺激素等。应根据病情的严重程度确定患者的随访频率[
2.转诊:出现下述情况的糖尿病患者应转诊至肾脏科:(1)糖尿病肾病进展至4~5期,考虑肾脏替代治疗;(2)临床考虑非糖尿病肾病,如eGFR短期内迅速下降、蛋白尿短期内迅速增加、肾脏影像学表现异常、合并难治性高血压等。
1. T2DM患者应在诊断后进行首次眼病筛查。T1DM患者在诊断后的5年内应进行综合性眼病检查。无DR者以后至少每1~2年复查1次,有DR者则应增加检查频率。(B)
2.良好地控制血糖、血压和血脂可预防或延缓DR的进展。(A)
3.中度及以上的NPDR及PDR患者应由眼科医师进行进一步分级诊治。
DR是常见的糖尿病慢性并发症,也是成人失明的主要原因[58,
存在微动脉瘤可作为鉴别DR与糖尿病合并其他眼底病变的指标。DR常与糖尿病肾病伴发。DR合并微量白蛋白尿可作为糖尿病肾病的辅助诊断指标[
目前推荐使用2002年国际眼病学会制定的DR分级标准,该标准将糖尿病黄斑水肿(DME)纳入到DR中进行管理[


DR(包括DME)的患者可能无明显临床症状,因此,定期做眼底检查非常重要。T2DM在诊断前常已存在一段时间,诊断时DR的发生率较高。因此,T2DM患者在确诊后应尽快进行首次眼底检查和其他方面的眼科检查[
在没有条件全面开展由眼科医师进行眼部筛查的情况下,可由内科经培训的技术人员使用免散瞳眼底照相机,拍摄至少2张以黄斑及视乳头为中心的角度为45°的眼底后极部彩色照片进行分级诊断,是可行的DR筛查方法[
人工智能(AI)在DR的筛查和分级诊断方面展现出了巨大的潜力。采用AI的自动眼底筛查技术,诊断DR的准确度为90%~98%[
无DR且血糖控制良好的患者至少每1~2年筛查1次;轻度NPDR患者每年1次,中度NPDR患者每3~6个月1次,重度NPDR患者每3个月1次;对于有临床意义的黄斑水肿应每3个月进行复查。如果DR进展或威胁视力,需增加监测频率,由眼科医师或有经验的验光师进行散瞳眼底检查[
患有糖尿病的女性如果准备妊娠,应做详细的眼科检查,告知妊娠可增加DR的发生危险和(或)使其进展。怀孕的糖尿病患者应在妊娠前或第1次产检、妊娠后每3个月及产后1年内进行眼科检查。妊娠期糖尿病和妊娠期显性糖尿病患者发生的DR危险并不增高,随访次数可不遵循上述推荐[
及时的眼科转诊治疗非常重要,是预防失明的主要环节。如果存在以下初筛结果,需及时至眼科就诊,包括:(1)中度NPDR;(2)非累及黄斑中心凹的DME于3~6个月内至眼科诊查;(3)重度NPDR、PDR、非累及黄斑中心凹的DME需立即至眼科诊治[
1.健康教育:通过对糖尿病患者及其家属的健康教育,使其能够掌握DR危险因素相关知识,鼓励患者坚持健康的生活方式,遵循有效的随访计划,进而达到DR的早防早治。
2. DR的内科治疗:
(1)血糖、血压和血脂的良好控制可预防或延缓DR的进展[48,
(2)非诺贝特可减缓DR进展,减少激光治疗需求[
(3)轻中度的NPDR患者在控制代谢异常和干预危险因素的基础上,可进行内科辅助治疗和随访。这些辅助治疗的循证医学证据尚不多。目前常用的辅助治疗包括:抗氧化、改善微循环类药物,如羟苯磺酸钙[
(4)对于DME,抗血管内皮生长因子注射治疗比单纯激光治疗更具成本效益[58]。
(5)糖皮质激素局部应用可用于威胁视力的DR和DME[58]。
(6)DR不是使用阿司匹林治疗的禁忌证,阿司匹林对DR没有疗效,但也不会增加视网膜出血的风险[58]。
3.眼科治疗:激光光凝术仍是高危PDR患者及某些严重NPDR患者的主要治疗方法[
1.所有T2DM患者确诊时和T1DM患者诊断5年后,应进行糖尿病神经病变筛查。随后至少每年筛查1次。(B)
2.评估DSPN应包括详细病史,检查温度觉、针刺觉(小纤维功能)、踝反射、压力觉和震动觉(大纤维功能)。(B)
3.良好的血糖控制可以延缓糖尿病神经病变的进展。(B)
4.普瑞巴林、加巴喷丁或度洛西汀可作为糖尿病痛性神经病变的初始治疗药物。(A)
糖尿病神经病变是糖尿病最常见的慢性并发症。T2DM患者神经病变的发生发展与糖尿病病程、血糖控制状况、肥胖、胰岛素抵抗和慢性低度炎症等因素相关,病程10年以上者易出现明显的神经病变临床表现[
1.弥漫性神经病变:(1)DSPN:双侧远端对称性肢体疼痛、麻木、感觉异常等,最常见类型为大神经纤维和小神经纤维同时受累,部分可为以大神经纤维或小神经纤维受累为主的临床表现。(2)自主神经病变:可累及心血管、消化、泌尿生殖等系统,还可出现体温调节、泌汗异常及低血糖无法感知、瞳孔功能异常等。
2.单神经病变:可累及单颅神经或周围神经。颅神经损伤以上睑下垂(动眼神经)最常见,其他包括面瘫(面神经)、眼球固定(外展神经)、面部疼痛(三叉神经)及听力损害(听神经)等。单发周围神经损伤包括尺神经、正中神经、股神经和腓总神经等。同时累及多个单神经的神经病变为多灶性单神经病变,需与多发性神经病变相鉴别。
3.神经根神经丛病变:最常见为腰段多发神经根神经丛病变,常表现为单侧、以肢体近端为主的剧烈疼痛,伴有单侧、近端肌无力、肌萎缩。
1. DSPN的筛查:DSPN是糖尿病神经病变的最常见类型。T2DM确诊时,T1DM在诊断后5年应进行糖尿病神经病变筛查,随后至少每年筛查1次。有典型症状者易于发现和诊断,最常见的早期症状包括疼痛和感觉异常等,但高达50%的DSPN患者可能无症状[
2. DSPN的诊断:
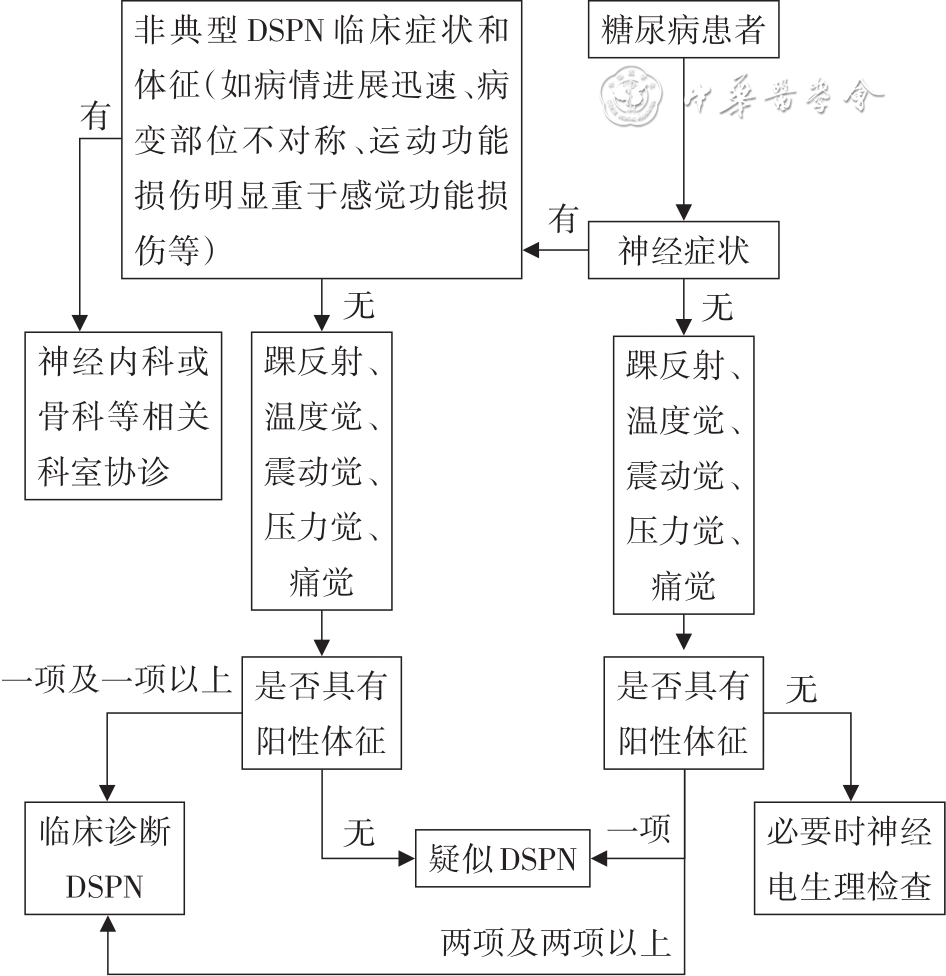
(1)诊断依据:①明确的糖尿病病史;②诊断糖尿病时或之后出现的神经病变;③临床症状和体征与DSPN的表现相符;④排除以下情况:尤其当存在病情进展迅速、病变部位不对称、运动功能损伤明显重于感觉功能损伤等情况时,需排除其他病因引起的神经病变,如颈腰椎病变(神经根压迫、椎管狭窄、颈腰椎退行性变)、脑梗死、格林-巴利综合征;严重动静脉血管性病变(静脉栓塞、淋巴管炎)等;维生素B12缺乏;感染(如人类免疫缺陷病毒等);药物尤其是化疗药物引起的神经毒性作用以及肾功能不全引起的代谢毒物对神经的损伤。神经肌电图检查并非诊断糖尿病神经病变的必要手段,但其在糖尿病合并神经病变的鉴别诊断中具有重要价值[58,
(2)诊断分层[58,
(3)临床诊断流程:主要根据临床症状和体征,临床诊断有疑问时,可以做神经传导功能检查等。DSPN的诊断流程图见
3.糖尿病自主神经病变的诊断
(1)心血管自主神经病变:表现为静息性心动过速、直立性低血压、晕厥、冠状动脉舒缩功能异常、无痛性心肌梗死、心脏骤停或猝死等。可以采用心血管反射试验、心率变异性及体位变化时血压测定、24 h动态血压监测等辅助诊断[
(2)消化系统自主神经病变:表现为吞咽困难、呃逆、胃轻瘫、便秘及腹泻等。在诊断胃轻瘫之前需排除胃出口梗阻或其他器质性原因。胃电图、测定胃排空的闪烁图扫描(测定固体和液体食物排空的时间)等有助于诊断[
(3)泌尿生殖系统自主神经病变:膀胱功能障碍表现为排尿障碍、尿失禁、尿潴留、尿路感染等。超声检查可判定膀胱容量、残余尿量等,有助于诊断糖尿病神经源性膀胱。性功能障碍在男性可导致勃起功能障碍和(或)逆向射精[
(4)其他自主神经病变:表现为出汗减少或无汗,从而导致手足干燥开裂,容易继发感染。对低血糖感知异常,当支配内分泌腺体的自主神经发生病变时,糖尿病患者在低血糖时应激激素如儿茶酚胺、生长激素等分泌常延迟或减少,造成患者对低血糖感知减退或无反应,低血糖恢复的时间延长。
1.针对病因治疗[58,
2.针对神经病变的发病机制治疗:(1)抗氧化应激:通过抑制脂质过氧化,增加神经营养血管的血流量,增加神经Na+-K+-ATP酶活性,保护血管内皮功能。常用药物为α-硫辛酸[58,
3.疼痛管理:治疗糖尿病痛性神经病变的药物包括[
4.自主神经病变的治疗:(1)体位性低血压:除了非药物治疗外,米多君和屈昔多巴可用于治疗。此外,患者仰卧位血压较高时,可考虑在就寝时使用短效降压药(如卡托普利、可乐定等)[
戒烟及血糖、血压、血脂、体重等良好的代谢管理等是预防糖尿病神经病变发生的重要措施,尤其是血糖控制至关重要。定期进行神经病变的筛查及评估,重视足部护理,可以降低足部溃疡的发生风险。
1.筛查LEAD的高危因素并给予早期干预,纠正不良生活方式,可以预防LEAD的发生和延缓病情进展。(A)
2.指导LEAD患者积极进行运动康复训练,可以增加步行距离,改善患者的下肢运动功能,且不增加不良事件的发生。(A)
3.所有确诊的LEAD患者,包括无症状的ABI异常患者,都应该接受抗血小板治疗。(A)
4.扩血管治疗对于轻~中度的LEAD患者有较好的疗效。(A)
5.所有糖尿病足溃疡怀疑CLI存在时,应尽早完成血管评估,并尽快完成血管重建手术,可显著减少大截肢手术的发生,提高患者的生存质量。(A)
6.在CLI患者,应用低分子肝素联合阿司匹林能显著降低患者血管腔内微创治疗引起的血管闭塞或再狭窄。(B)
7.当CLI患者出现不能耐受的疼痛、肢体坏死或感染播散,应考虑行截肢手术。(A)
下肢动脉病变是外周动脉疾病的一个组成成分,表现为下肢动脉的狭窄或闭塞。与非糖尿病患者相比,糖尿病患者更常累及股深动脉及胫前动脉等中小动脉[
由于LEAD与冠状动脉疾病(CAD)和脑血管疾病等动脉血栓性疾病在病理机制上有共性,如内皮功能的损害、氧化应激等,因此,在临床上这几种病变常同时存在,故LEAD对CAD和脑血管疾病有提示价值[
LEAD患者中只有10%~20%有间歇性跛行的表现[
对于50岁以上的糖尿病患者,应该常规进行LEAD的筛查。伴有LEAD发病危险因素(如合并心脑血管病变、血脂异常、高血压、吸烟或糖尿病病程5年以上)的糖尿病患者应该每年至少筛查1次[

注:LEAD为下肢动脉粥样硬化病变;ABI为踝肱指数;TBI为趾肱指数
糖尿病合并LEAD的诊断依据包括[
LEAD一旦诊断,临床上应该进行Fontaine分期(

1.LEAD的治疗目的包括:预防全身动脉粥样硬化疾病的进展,预防心血管事件,预防缺血导致的溃疡和肢端坏疽,预防截肢或降低截肢平面,改善间歇性跛行患者的功能状态[
2.糖尿病性LEAD的预防:糖尿病性LEAD的规范化防治包括3个部分,即一级预防(防止或延缓LEAD的发生)、二级预防(缓解症状,延缓LEAD的进展)和三级预防(血运重建,降低截肢和心血管事件发生)。
(1)糖尿病性LEAD的一级预防[
(2)糖尿病性LEAD的二级预防:在一级预防的基础上,对于有症状的LEAD患者,建议应用小剂量阿司匹林,剂量建议为75~100 mg/d[
(3)糖尿病性LEAD的三级预防:主要针对慢性CLI患者,CLI患者往往表现为静息痛、坏疽、溃疡不愈合,且具有极高的截肢和心血管死亡风险,血管病变主要是股腘动脉闭塞。根据缺血持续时间分为急性(≤2周)和慢性(>2周),以慢性更为常见。由于CLI患者血管重建术后3年累积截肢或死亡率高达48.8%,远高于间歇性跛行患者(12.9%)[
在内科保守治疗无效时,需行各种血管重建手术,包括外科手术治疗和血管腔内治疗,可大大降低截肢率,改善生活质量[
LEAD的三级预防要求临床上做到多学科协作[
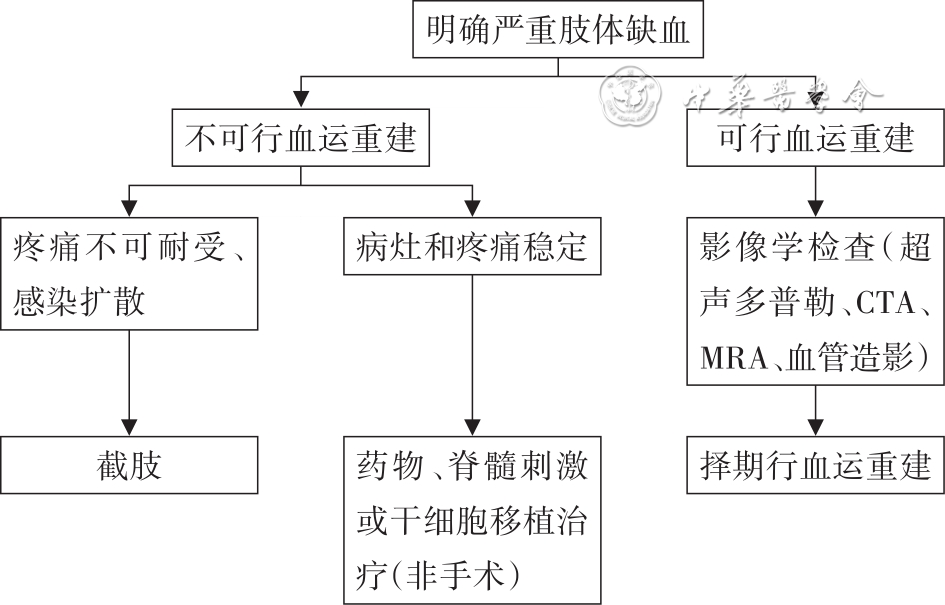
在CLI患者,应用低分子肝素联合阿司匹林能显著降低患者血管腔内微创治疗引起的血管闭塞或再狭窄。CLI的治疗流程图见
注:CTA为CT血管成像;MRA为磁共振血管成像
1.对所有糖尿病患者每年进行全面的足部检查,详细询问以前大血管及微血管病变的病史,评估目前神经病变的症状(疼痛、烧灼、麻木感)和下肢血管疾病(下肢疲劳、跛行)以确定溃疡和截肢的危险因素。(B)
2.检查应包括皮肤视诊、评估足部畸形、神经评估(10 g尼龙丝试验和针刺或振动觉试验或踝反射)、血管评估(下肢和足部血管搏动)。(B)
3.对所有糖尿病患者都应该给予综合的足部自我管理的教育。(B)
4. DFU的治疗强调多学科协作诊治。(B)
糖尿病足病是糖尿病严重和治疗费用高的慢性并发症之一,重者可以导致截肢和死亡。我国14省市17家三甲医院的调查结果显示,2018年住院慢性创面的常见原因为糖尿病与感染,2007至2008年为糖尿病与创伤,而1996年糖尿病仅占慢性创面病因的4.9%,提示目前我国慢性皮肤创面的病因与发达国家相似[
糖尿病足病是指初诊糖尿病或已有糖尿病病史的患者,足部出现感染、溃疡或组织的破坏,通常伴有下肢神经病变和(或)周围动脉病变(PAD)[
糖尿病足病一旦诊断,临床上应该进行分级评估,目前临床上广为接受的分级方法主要是Wagner分级(


糖尿病足病强调“预防重于治疗”[
系统的糖尿病足病相关知识教育可以减少糖尿病足病高危患者足溃疡的发生[
预防糖尿病足病的关键点在于:定期检查患者是否存在糖尿病足病的危险因素;识别出这些危险因素;教育患者及其家属和有关医务人员进行足的保护;穿着合适的鞋袜;去除和纠正容易引起溃疡的因素[
糖尿病足患者及其家属的教育内容包括:每天检查双足,特别是足趾间;有时需要有经验的他人来帮助检查足;定期洗脚,用干布擦干,尤其是擦干足趾间;洗脚时的水温要合适,低于37 ℃;不宜用热水袋、电热器等物品直接保暖足部;避免赤足行走;避免自行修剪胼胝或用化学制剂来处理胼胝或趾甲;穿鞋前先检查鞋内有否异物或异常;不穿过紧的或毛边的袜子或鞋;足部皮肤干燥可以使用油膏类护肤品;每天换袜子;不穿高过膝盖的袜子;水平地剪趾甲;由专业人员修除胼胝或过度角化的组织;一旦有问题,及时至专科医师或护士处诊治[
1.在进行足溃疡治疗之前,首先要评估溃疡性质[
2.合理地降糖、降压、调脂和抗血小板治疗(见相关章节)。
3.积极治疗糖尿病性下肢动脉病变(见相关章节)。
4.足溃疡感染的处理:糖尿病足感染必须通过临床诊断,以局部或全身的体征或炎症的症状为基础[
在选择抗生素控制感染之前,应进行溃疡创面细菌培养和药敏试验,细菌培养方法可选择严格清创后的棉拭子及病理组织培养[
(1)足溃疡创面的处理:彻底的DFU清创,有利于溃疡愈合[
(2)物理治疗:足溃疡创面高压氧治疗,有助于改善创面的炎症和微循环状况。在合并LEAD的缺血性足溃疡患者,高压氧治疗不能促进创面愈合,但能够降低大截肢率[
5.转诊或会诊:非糖尿病足病专业的医务人员,应掌握在何种情况下糖尿病足病需要及时转诊或会诊。一旦出现以下情况,应该及时转诊至糖尿病足病专科或请血管外科、骨科、创面外科等相关专科会诊,包括皮肤颜色的急剧变化、局部疼痛加剧并有红肿等炎症表现、新发生的溃疡、原有的浅表溃疡恶化并累及软组织和(或)骨组织、播散性的蜂窝组织炎、全身感染征象、骨髓炎等。及时转诊或多学科协作诊治有助于提高溃疡愈合率,降低截肢率和减少医疗费用。
1.低血糖分级:1级低血糖:血糖<3.9 mmol/L且≥3.0 mmol/L;2级低血糖:血糖<3.0 mmol/L;3级低血糖:没有特定血糖界限,伴有意识和(或)躯体改变的严重事件,需要他人帮助的低血糖。
2.有低血糖风险的患者每次就诊时应询问有无低血糖症状。(C)
3.使用有低血糖风险的降糖药治疗的患者应评估、筛查无症状性低血糖。(C)
4.糖尿病患者如发生低血糖,应给予15~20 g葡萄糖并于15 min后检测血糖。(B)
5.胰岛素治疗的患者如发生无症状性低血糖或1次3级低血糖或无诱因的2级低血糖,应放宽血糖控制目标,在数周内严格避免低血糖,以部分逆转无症状性低血糖并降低未来低血糖风险。(A)
糖尿病患者在治疗过程中可能发生血糖过低现象。低血糖可导致不适甚至生命危险,也是血糖达标的主要障碍,应该引起特别注意。
对非糖尿病患者来说,低血糖症的诊断标准为血糖<2.8 mmol/L,而接受药物治疗的糖尿病患者只要血糖<3.9 mmol/L就属于低血糖。
胰岛素、磺脲类和非磺脲类胰岛素促泌剂均可引起低血糖。二甲双胍、α-糖苷酶抑制剂、噻唑烷二酮、二肽基肽酶Ⅳ抑制剂(DPP-4i)、胰高糖素样肽-1受体激动剂(GLP-1RA)和钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)不增加低血糖风险,这些药物单用一般不诱发低血糖,但和胰岛素及胰岛素促泌剂联合治疗时则可引起低血糖。对于使用可能导致低血糖药物的患者,应考虑可能出现的无症状性低血糖,需筛查评估无症状性低血糖的风险[
低血糖的临床表现与血糖水平以及血糖的下降速度有关,可表现为交感神经兴奋(如心悸、焦虑、出汗、头晕、手抖、饥饿感等)和中枢神经症状(如神志改变、认知障碍、抽搐和昏迷)。老年患者发生低血糖时常可表现为行为异常或其他非典型症状。有些患者发生低血糖时可无明显的临床症状,称为无症状性低血糖,也称为无感知性低血糖或无意识性低血糖。有些患者屡发低血糖后,可表现为无先兆症状的低血糖昏迷[
1. 1级低血糖:血糖<3.9 mmol/L且≥3.0 mmol/L。
2. 2级低血糖:血糖<3.0 mmol/L。
3. 3级低血糖:需要他人帮助治疗的严重事件,伴有意识和(或)躯体改变,但没有特定血糖界限[
1.未按时进食,或进食过少:患者应定时、定量进餐,如果进餐量减少则相应减少降糖药物剂量,有可能误餐时应提前做好准备。
2.呕吐、腹泻:呕吐、腹泻可使机体能量(尤其是碳水化合物)摄入减少,从而诱发低血糖。如果患者有呕吐、腹泻等表现,需及时治疗并调整降糖药的剂量,同时加强血糖监测。
3.酒精摄入,尤其是空腹饮酒:酒精能直接导致低血糖,应避免酗酒和空腹饮酒。
4.运动增加:根据患者病情和身体素质选择适合自己的运动方式,运动前应增加额外的碳水化合物摄入,预防低血糖发生。
5.自主神经功能障碍:糖尿病患者常伴有自主神经功能障碍,自主神经功能障碍影响机体对低血糖的调节能力,增加发生严重低血糖的风险。同时,低血糖也可能诱发或加重患者自主神经功能障碍,形成恶性循环。
6.肝、肾功能不全:合并肝、肾功能不全的糖尿病患者易于发生低血糖,与肝、肾功能不全引起纳差及糖异生能力降低等因素有关。
7.胰岛素及胰岛素促泌剂的应用:胰岛素及胰岛素促泌剂可诱发低血糖,故使用这些药物应从小剂量开始,逐渐增加剂量,并做好血糖监测。患者如出现低血糖,应积极寻找原因,及时调整治疗方案和药物剂量。
8.血糖控制目标过严:严格的血糖控制会增加低血糖的风险,并且严重低血糖可能与患者死亡风险增加有关,因此,对有低血糖尤其是严重低血糖或反复发生低血糖的糖尿病患者除调整治疗方案外还应适当放宽血糖控制目标[
9.糖尿病患者应常规随身备用碳水化合物类食品,一旦发生低血糖,立即食用。
10.自我血糖监测(SMBG)和持续葡萄糖监测(CGM)是评估疗效和早期识别低血糖的重要工具[
糖尿病患者血糖<3.9 mmol/L,即需要补充葡萄糖或含糖食物。严重的低血糖需要根据患者的意识和血糖情况给予相应的治疗和监护(
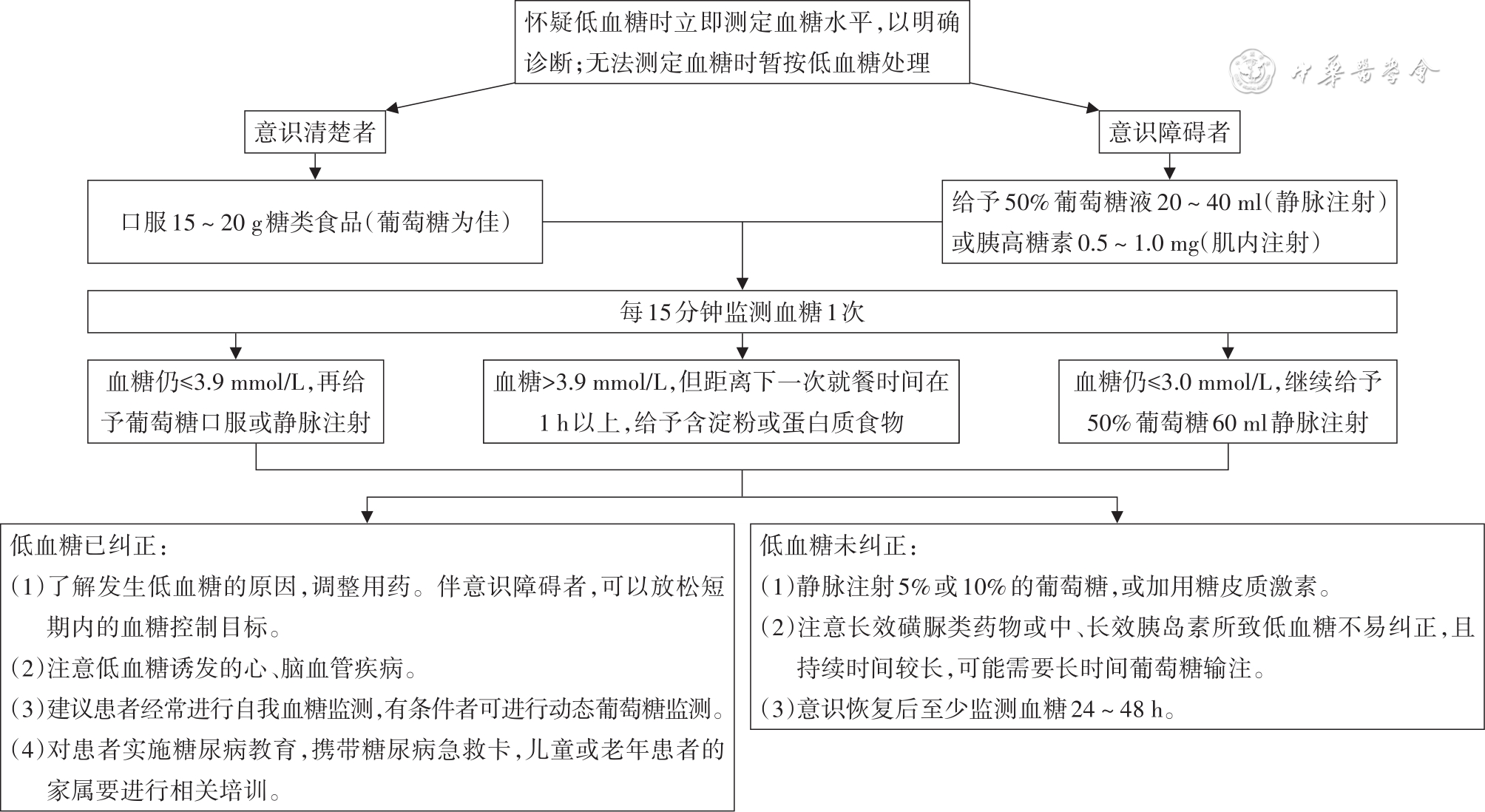
低血糖是糖尿病患者长期维持正常血糖水平的制约因素,严重低血糖发作会给患者带来巨大危害[
1.对于血糖持续≥10.0 mmol/L的住院糖尿病患者可以启用胰岛素治疗。(A)
2.当血糖<3.9 mmol/L时应采取措施或改变治疗方案,防止血糖进一步下降。(C)
院内高血糖是指住院患者随机血糖水平>7.8 mmol/L,若血糖水平持续而明显地高于此水平则提示患者有可能需要接受治疗[
住院患者发生高血糖非常普遍,包括入住内分泌科的成人糖尿病患者,其他内科、外科、急诊、重症监护科室的糖尿病或高血糖患者以及妊娠期糖尿病(GDM)或糖尿病合并妊娠患者等,制定患者的具体血糖控制目标需根据患者的疾病类型、严重程度等进行分层,遵循个体化原则。
住院患者的血糖监测主要采用便携式血糖仪进行床旁快速血糖检测,必要时也可使用持续葡萄糖监测(CGM),详见“第十二章糖尿病相关技术血糖监测”一节。可在充分评估患者病情后制定相应的血糖控制目标。血糖控制目标可分为严格、一般、宽松3个标准(
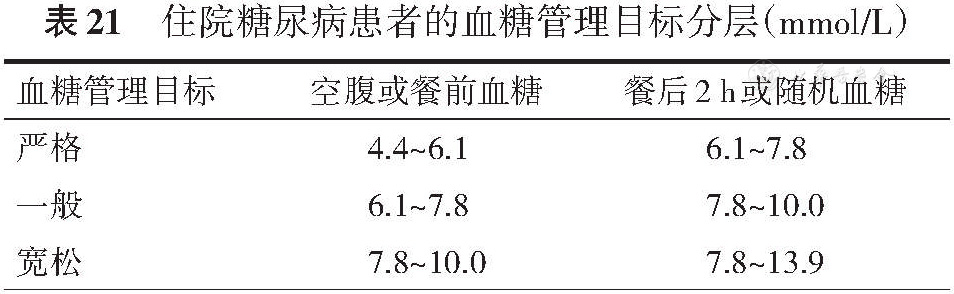
对于新诊断、非老年、无并发症及伴发疾病,降糖治疗无低血糖风险的糖尿病患者,以及拟行整形手术等精细手术的患者,住院期间建议严格控制血糖;伴有稳定心脑血管疾病的高危人群[具有高危心脑血管疾病风险(10年心血管风险>10%)者,包括大部分>50岁的男性或>60岁的女性合并1项危险因素者(即心血管疾病家族史、高血压、吸烟、血脂紊乱或蛋白尿)]、使用糖皮质激素的患者、择期行手术治疗的患者以及外科重症监护室的危重症患者建议选择一般血糖控制目标;对于低血糖高危人群[糖尿病病程>15年、存在无感知性低血糖病史、有严重伴发病(如肝肾功能不全)、全天血糖波动大并反复出现低血糖的患者],以及因心脑血管疾病入院、有中重度肝肾功能不全、75岁以上老年人、预期寿命<5年(如癌症等)、存在精神及智力障碍、行急诊手术、行胃肠内或外营养以及内科重症监护室的危重症患者,可使用宽松的血糖控制目标[
低血糖是代谢紊乱和(或)糖尿病治疗的严重后果,住院患者必须尽量减少低血糖。每个医院都应该设立标准化的低血糖预防和管理方案。血糖低于3.9 mmol/L时应采取措施或改变降糖方案,预防血糖进一步降低。此外,还应针对每个患者制定个体化预防和治疗低血糖的方案。在医院发生的低血糖事件应记录在病历中并进行跟踪。对所有低血糖发作应当查找原因,常见的低血糖原因除了胰岛素使用不当外,突然减少糖皮质激素剂量、减少进食、呕吐、静脉葡萄糖输注速度降低、肠内或肠外营养意外中断以及患者对低血糖反应减弱或不能及时表达,都可能导致医源性低血糖[
1.病情评估
(1)病因及病理生理特点:病因包括糖尿病病因及血糖控制不佳的原因,如家族史、胰岛相关抗体、生活方式、目前降糖方案及治疗依从性等;对于怀疑单基因突变糖尿病的患者可进行基因诊断;病理生理特点包括胰岛素抵抗、胰岛α及β细胞功能、尿糖水平等。
(2)血糖控制情况:所有患者如3个月内未检测HbA1c,应进行HbA1c检测;所有患者在住院期间均常规每天检测毛细血管血糖7次,必要时加测夜间血糖;对于使用胰岛素静脉输注的患者可每0.5~2.0小时监测1次血糖;对于血糖控制稳定的患者可监测早晚餐前、餐后2 h及睡前的5点血糖。有条件的患者可以使用CGM进行血糖监测。
(3)代谢综合征相关指标:糖尿病患者常伴随其他代谢异常,住院期间应评估血压、血脂、血尿酸、脂肪肝等代谢疾病的情况。
(4)糖尿病并发症评估:对于怀疑合并急性并发症的患者,需立即检测血糖、血酮或尿酮、血气分析、电解质、心肌酶谱、肾功能、血常规、尿常规、粪常规。对于所有糖尿病患者,住院期间应完成各种糖尿病慢性并发症评估。大血管并发症检查如颈动脉超声、四肢血管超声、经皮氧分压;微血管并发症检查如眼底、尿微量白蛋白;神经病变如神经电生理、感觉阈值等。
(5)糖尿病伴发症评估:糖尿病患者易合并感染、肿瘤、心理疾病及其他内分泌科疾病(如骨质疏松、甲状腺疾病等),住院期间可针对患者情况完善相应检查。
2.治疗:包括教育及生活方式干预,降糖治疗等。
3.出院前准备:(1)制订并告知院外降糖及综合治疗方案。院外降糖方案在住院期间逐步形成,或胰岛素强化治疗转为院外非胰岛素强化治疗方案时需要至少监测1 d的7次血糖,以评估治疗方案的有效性和安全性。(2)告知患者出院后血糖监测频率和控制目标。(3)制订体重管理与生活方式计划。(4)告知随访时间和内容。
1.主要疾病的治疗:非内分泌科患者的住院治疗以治疗主要疾病为主,降糖治疗为辅。
2.管理模式:我国住院血糖管理可以分为以下3种模式:(1)科室自我管理模式:住院患者血糖由患者所住科室医护人员、健康教育工作者、营养师、患者等共同参与的血糖管理模式;(2)会诊专业管理模式:非内分泌科住院患者血糖除由患者所住科室医护人员、健康教育工作者、营养师、患者等参与血糖管理外,血糖控制不良、控糖方案制定困难时,内分泌科医师通过会诊方式参与的血糖管理模式;(3)互联网系统管理模式:利用住院患者互联网管理系统,与患者血糖监测数据管理系统相结合,使院内任一科室糖尿病患者都能及时接受糖尿病医护的远程系统管理,包括糖尿病教育、监测及治疗方案制定与调整。医院可根据现有的医院管理现状及设施条件配置选择合适的血糖管理模式。
3.血糖管理原则:
(1)对血糖控制未达标的非内分泌科住院高血糖患者,尤其在合并有糖尿病酮症、糖尿病酮症酸中毒(DKA)和高渗性高血糖状态(HHS)等急性并发症的患者,建议邀请内分泌专科医师协同诊治。内分泌专科协同诊治可以减少住院时间,改善血糖控制,并改善预后[
(2)非内分泌科患者的血糖控制目标以一般及宽松的目标为主,应注意避免出现低血糖。
(3)对于大多数的非内分泌科住院高血糖患者而言,胰岛素是控制血糖的首选治疗方法。对于血糖持续>10.0 mmol/L的糖尿病住院患者,建议启用胰岛素治疗[
(4)降糖方案的选择:基本与内分泌科住院患者一致。对于合并DKA、高渗昏迷、乳酸酸中毒及因其他危重疾病在重症监护室住院治疗的急危重症患者,推荐采用持续静脉胰岛素输注,根据患者病情及血糖波动情况随时调整输液速度及胰岛素剂量;对于非急危重症患者,可考虑皮下胰岛素注射。胰岛素注射剂量根据进餐和睡眠时间进行设定。对于进食差或无法正常进食的患者,可考虑以基础胰岛素为主,辅以短效或速效胰岛素注射。与基础+餐时胰岛素治疗方案相比,预混胰岛素可能增加住院患者低血糖风险[
4.出院随访:出院小结应包括高血糖的病因信息、相关并发症与合并症、推荐的后续治疗方案等。出院时向患者及家属交代清楚降糖方案,确保新处方的安全性;正确使用并处置胰岛素皮下注射针头和注射器;提供购买相关医疗设备或耗材的信息(如胰岛素笔、便携式血糖仪);对药物的服用方法、药品的管理、血糖监测、高血糖和低血糖的识别、预防和应急处理进行宣传教育。内分泌科医师应协同他科医师随访患者,建议所有糖尿病或高血糖患者在出院1个月后至内分泌科随访。糖尿病患者根据出院后的血糖水平,由内分泌专科医师进行降糖方案的调整并制订长期随访方案。对于住院新发现的高血糖患者更有必要在出院后重新进行糖代谢状态的评估。对于需要长期共同随访的患者,如糖尿病视网膜病变、糖尿病肾病、妊娠期糖尿病等,可由相关科室与内分泌科设立共同门诊。
1.对多数住院围手术期糖尿病患者推荐血糖控制目标为7.8~10.0 mmol/L。(A)
2.急诊手术,应尽快做术前准备,并同时给予胰岛素控制血糖,推荐胰岛素静脉输注治疗。(C)
3.对于口服降糖药血糖控制不佳及接受大中手术的患者,应及时改为胰岛素治疗,基础胰岛素联合餐时胰岛素可以有效改善血糖控制。(C)
4.围手术期应加强血糖监测,预防低血糖。(C)
5.应为糖尿病患者提供个体化的术后出院降糖治疗计划。(C)
糖尿病患者因各种疾病要进行手术治疗时需要得到特别的关注。因为糖尿病患者常合并大血管和微血管并发症,这将增加手术风险。手术应激还可使血糖急剧升高,增加术后管理的难度,亦是术后病死率增加的原因之一。此外,高血糖可造成感染发生率增加,伤口愈合延迟,住院时间延长,影响患者的远期预后[
1.术前准备及评估
(1)择期手术:应对血糖控制以及可能影响手术预后的糖尿病并发症进行全面评估。术前应检查所有糖尿病患者的随机血糖和HbA1c,以评估血糖控制情况,若随机血糖≥12.0 mmol/L或HbA1c≥9.0%,建议推迟手术[
(2)急诊手术:主要评估血糖水平和有无酸碱、水、电解质平衡紊乱。如果存在,推荐先纠正代谢紊乱,使pH值和渗透压接近正常后再进行手术。如手术有利于减轻或缓解危急病情,无需在术前严格设定血糖控制目标,应尽快做术前准备,并同时给予胰岛素控制血糖,推荐予胰岛素静脉输注治疗。
2.术中处理:对于仅需单纯饮食治疗或小剂量口服降糖药即可使血糖控制达标的2型糖尿病(T2DM)患者,在接受小手术时,术中不需要使用胰岛素。
在大中型手术术中,需静脉输注胰岛素,并加强血糖监测。一般患者建议每1~2小时监测1次血糖;危重患者、大手术和持续静脉输注胰岛素患者,建议使用标准血糖仪每0.5~1.0小时监测1次,或使用CGM。血糖控制的目标为7.8~10.0 mmol/L。术中可同时输注5%葡萄糖注射液,输注速度为100~125 ml/h,以防止低血糖。葡萄糖-胰岛素-钾联合输入是代替分别输入胰岛素和葡萄糖的简单方法,需根据血糖变化及时调整葡萄糖与胰岛素的比例。
3.术后处理:在患者恢复正常饮食前仍予胰岛素静脉输注,术后胰岛素输注应继续维持24 h以上,同时补充葡萄糖,保持随机血糖在7.8~10.0 mmol/L[
对于术后需要重症监护或机械通气的患者,如血浆葡萄糖>10.0 mmol/L,通过持续静脉胰岛素输注将血糖控制在7.8~10.0 mmol/L范围内比较安全。
中、小手术后一般的血糖控制目标为空腹血糖6.1~7.8 mmol/L,随机血糖7.8~10.0 mmol/L。既往血糖控制良好的患者可考虑更严格的血糖控制,同样应注意防止低血糖的发生。
4.围手术期低血糖的处理:应根据患者低血糖的水平决定输注的液体类型及监测血糖的频率。术中血糖<3.9 mmol/L时,建议50%葡萄糖注射液15 g静脉推注,并暂停胰岛素输注,15~30 min监测1次血糖;血糖为3.9~5.6 mmol/L,建议减慢胰岛素输注速度,每小时监测1次血糖;血糖为5.6~10.0 mmol/L,不需特殊处理,每1~2小时监测血糖1次。术前或术后如发生低血糖,对于可进食的清醒患者,口服10~25 g快速吸收的碳水化合物(如含糖饮料);不能口服的患者,静脉推注50%葡萄糖注射液20~50 ml,之后持续静脉点滴5%或10%葡萄糖注射液维持血糖,每15~20分钟监测1次直至血糖≥5.6 mmol/L[
5.术后出院前准备:为糖尿病患者提供个体化的出院降糖治疗计划可以减少住院时间和再住院率,并提高患者满意度[
1.所有糖尿病患者应计划妊娠,建议糖尿病患者HbA1c<6.5%时计划妊娠,孕前评价糖尿病控制状态及慢性并发症的情况。(B)
2.所有未被诊断糖尿病的孕妇于孕24~28周行一步法75 g OGTT筛查。(A)
3.推荐SMBG(空腹和餐后),根据个体情况调整监测频率及时点,以实现血糖控制及降低低血糖风险。除SMBG外,CGM为部分患者血糖监测的有益补充,更高的TIR提示更好的血糖达标。(B)
4.生活方式改变是妊娠期高血糖治疗的基础,如果不能达到治疗目标,应该加用药物治疗。(A)
5.孕期降糖药物首选胰岛素,所有口服药物均缺乏长期安全性的数据。(A)
6.二甲双胍孕期应用安全性研究增多,对胰岛素抵抗重、胰岛素剂量大的孕妇,可在知情同意的基础上,酌情继续应用或加用二甲双胍。(B)
7.产后4~12周应再次评价糖代谢状况,之后酌情每1~3年行75 g OGTT。(A)
全球20岁以上孕妇高血糖患病率15.8%,每年超过2 000万孕妇罹患此症[
1.妊娠期糖尿病(GDM):GDM是指妊娠期间发生的糖代谢异常,但血糖未达到显性糖尿病的水平,占妊娠期高血糖的83.6%[
2.妊娠期显性糖尿病(ODM):也称妊娠期间的糖尿病,指孕期任何时间被发现且达到非孕人群糖尿病诊断标准,约占孕期高血糖的8.5%[
3.孕前糖尿病(PGDM):指孕前确诊的1型糖尿病(T1DM)、T2DM或特殊类型糖尿病,约占孕期高血糖的7.9%[
1.孕前咨询:(1)计划妊娠之前回顾如下病史:①糖尿病的病程;②急性并发症;③慢性并发症;④糖尿病治疗情况;⑤其他伴随疾病和治疗情况;⑥月经史、生育史、节育史;⑦家庭和工作单位的支持情况。(2)评估代谢与妊娠之间的相互影响:评价血糖、HbA1c、血压、血脂、肝肾功能、体重等指标。(3)评价糖尿病慢性并发症:①视网膜病变:妊娠可加重糖尿病视网膜病变,未经治疗的增殖期视网膜病变不建议怀孕。②糖尿病肾病:妊娠可加重已有的肾脏损害,妊娠可对部分患者的肾功能造成永久性损害,肾功能不全对胎儿的发育有不良影响[
2.关于孕前药物应用:对二甲双胍无法控制的高血糖及时加用或改用胰岛素控制血糖,停用二甲双胍以外的其他类别口服降糖药;停用血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂和利尿剂类降压药,改为拉贝洛尔或二氢吡啶类钙通道阻滞剂控制血压;停用他汀类及贝特类调脂药物。
3.孕前综合管理:(1)加强糖尿病相关知识教育,戒烟。(2)血糖控制目标:在不出现低血糖的前提下,空腹和餐后血糖尽可能接近正常,建议HbA1c<6.5%时妊娠。应用胰岛素治疗者HbA1c<7.0%[23],餐前血糖控制在3.9~6.5 mmol/L,餐后血糖在8.5 mmol/L以下[
1.高危人群筛查:妊娠期高血糖危险人群包括:有GDM史、巨大儿分娩史、肥胖、多囊卵巢综合征(PCOS)、一级亲属糖尿病家族史、早孕期空腹尿糖阳性、无明显原因的多次自然流产史、胎儿畸形及死胎史、新生儿呼吸窘迫综合征分娩史等[23]。妊娠期高危人群第1次产检即应检查血糖,如达到非孕人群糖尿病诊断标准,可诊断ODM。具有GDM高危因素,如第1次产检血糖正常,应定期检测血糖,必要时及早行OGTT。如果血糖持续正常,也必须于孕24~28周行75 g OGTT,必要时孕晚期再次评估。
2.非高危人群筛查:建议所有未曾评估血糖的孕妇于妊娠24~28周行一步法75 g OGTT评估糖代谢状态。
1.饮食和运动的指导:建议营养师参与医学营养治疗,妊娠期间的饮食原则为既能保证孕妇和胎儿营养需要,又能维持血糖在正常范围,而且不发生饥饿性酮症。尽可能选择血糖生成指数不高的食物。应实行少量多餐制,每日分5~6餐,主食的1/3~1/2分餐到加餐有助于餐后血糖的控制[
2.血糖监测:血糖控制稳定或不需要胰岛素治疗的GDM妇女,每周至少测定1次全天4点(空腹和三餐后2 h)血糖。其他患者酌情增加测定次数。CGM适用于血糖欠佳的PGDM,尤其是T1DM患者。因孕中晚期红细胞转换速度加快,以及受妊娠期贫血影响,HbA1c常常被低估,对GDM的应用价值有限。PGDM患者的HbA1c结果判定需考虑影响因素。
3.血压监测及治疗:妊娠期高血压疾病主要包括妊娠期高血压及原发性高血压合并妊娠,当收缩压≥140 mmHg和(或)舒张压≥90 mmHg时,应考虑降压药物治疗。常用口服降压药包括拉贝洛尔(每次50~150 mg,3~4次/d)、二氢吡啶类钙通道阻滞剂、α受体阻滞剂酚妥拉明[23]。孕期不推荐使用ACEI和ARB类降压药。降压过程中需与产科医师密切合作,判断有无子痫前期或更重的妊娠期高血压状态[
4.体重管理:孕前肥胖及孕期体重增加过多均是GDM的高危因素。需从孕早期即制定孕期增重计划,结合基础体重指数(BMI),了解孕期允许增加的体重。孕期规律产检,监测体重变化,保证合理的体重增长(
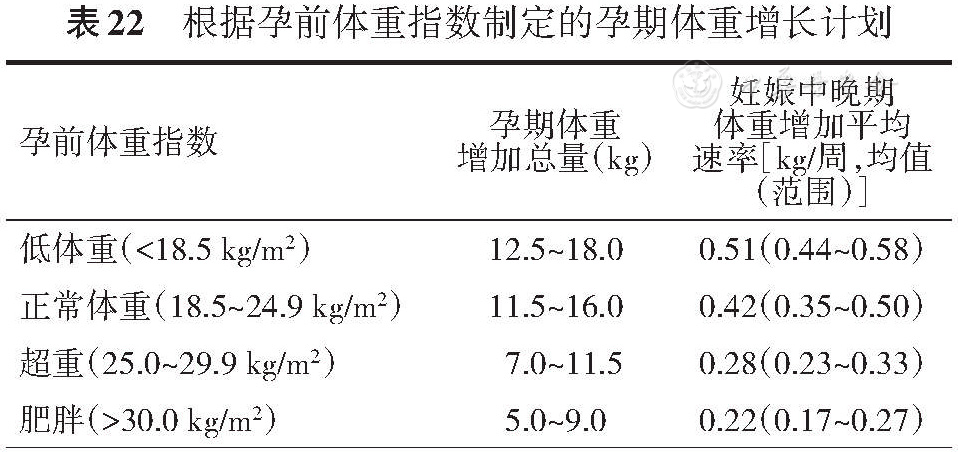
5.孕期降糖药物
(1)胰岛素:①可应用于孕期的胰岛素类型:包括所有的人胰岛素(短效、中效及预混的人胰岛素)、胰岛素类似物(门冬胰岛素[
(2)二甲双胍:除二甲双胍外,其他口服降糖药均不推荐应用于孕期。多项二甲双胍与胰岛素在妊娠期应用的头对头研究及荟萃分析[
6.妊娠期血糖控制目标与低血糖:(1)所有类型的妊娠期高血糖孕期血糖目标:空腹血糖<5.3 mmol/L,餐后1 h血糖<7.8 mmol/L,餐后2 h血糖<6.7 mmol/L。随着对疾病认识的深入,葡萄糖目标范围内时间(TIR)成为血糖控制的重要目标,孕期T1DM力求TIR>70%,T2DM及GDM至少应>90%,尽可能减少葡萄糖低于目标范围时间(TBR)及葡萄糖高于目标范围时间(TAR)[
7.妊娠期高血糖产后管理:(1)妊娠期高血糖对母儿两代人的影响不因妊娠终止而结束。(2)产后GDM停用胰岛素,PGDM和ODM胰岛素剂量至少减少1/3。(3)鼓励母乳喂养。(4)PGDM产后管理同普通人群,ODM产后需要重新评估糖尿病类型及糖代谢状态,GDM需进行短期及长期随访,母儿两代人代谢相关疾病风险均明显增加。(5)GDM随访:产后4~12周行75 g OGTT评估糖代谢状态。长期随访为GDM产后1年再行75 g OGTT评价糖代谢状态。之后的随访间期为无高危因素者1~3年OGTT筛查1次。
1.儿童和青少年T2DM在诊断的同时要注意是否存在伴发病或并发症,包括高血压、微量白蛋白尿、眼底病变等,以及睡眠呼吸障碍、血脂异常和肝脏脂肪变性等。(A)
2.青春期应注意是否合并PCOS。(B)
3.起始的药物治疗可以单用二甲双胍或胰岛素,或者两者联合使用。(A)
4.如果存在糖尿病症状、严重高血糖、酮症或DKA则需要胰岛素治疗,一旦酸中毒纠正,联合二甲双胍治疗。(A)
近年来,儿童和青少年糖尿病发病率明显上升,尤其是低龄儿童[
随着儿童肥胖的增多,T2DM表现出明显的上升趋势。我国一项多中心研究及浙江地区的调查均显示,T2DM呈明显上升趋势[
与儿童T1DM不同,儿童T2DM是胰岛素抵抗与β细胞功能减退共同致病。与成人T2DM不同的是,儿童的胰岛β细胞功能衰减的速度更快,更早出现糖尿病并发症[
T2DM患儿的临床表现轻重不一,轻者仅有肥胖,往往在体检时发现高血糖或尿糖阳性,重者可出现酮症,甚至酮症酸中毒。首先进行糖尿病诊断,之后再鉴别分型。糖尿病的诊断标准与成人标准一致。T2DM患儿一般有家族史、体型肥胖、起病隐匿、症状不明显、发病年龄较大、无需使用胰岛素治疗或存在和胰岛素抵抗相关的并发症,如黑棘皮病、高血压、血脂异常、PCOS、脂肪肝等。
随着肥胖率的升高,T1DM患儿也常常合并超重及肥胖[

总体目标是:通过饮食控制和体育锻炼取得和维持标准体重、减轻胰岛β细胞负荷,使血糖处于正常水平;减少低血糖的发生;防止相关病变(高血压、高血脂、肾病、非酒精性脂肪肝等)出现。
1.健康教育:不仅针对T2DM患儿个体进行健康和心理教育,同时更要对患儿家庭成员进行糖尿病相关知识的普及。合理的生活方式对病情的控制尤为重要。
2.饮食治疗:饮食控制以维持标准体重、纠正已发生的代谢紊乱和减轻胰岛β细胞的负担为原则。6~12岁儿童为900~1 200 kcal/d,13~18岁则在1 200 kcal/d以上。推荐每日碳水化合物供能比为50%~55%,建议碳水化合物来自于低血糖生成指数、富含膳食纤维的食物。脂肪的摄入为25%~35%为宜,应增加植物脂肪占总脂肪摄入的比例,限制饱和脂肪酸与反式脂肪酸的摄入量,饱和脂肪酸的摄入量不应超过供能比的10%。蛋白质摄入量占总能量的15%~20%。植物来源蛋白质,尤其是大豆蛋白更有助于降低血脂水平。膳食纤维可改善餐后血糖和长期糖尿病控制,谷物膳食纤维还可增强胰岛素敏感性,推荐糖尿病患儿的膳食纤维摄入量为10~14 g/1 000 kcal。长期坚持低脂饮食或胰岛素治疗患儿使用碳水化合物计算法HbA1c更低[
3.运动治疗:运动在儿童和青少年T2DM的治疗中占有重要的地位,有利于减轻体重,增加胰岛素的敏感性,增加外周组织对糖的摄取,减少胰岛素的用量。运动方式和运动量的选择应该个体化,根据性别、年龄、体型、体力、运动习惯和爱好制订适当的运动方案。运动方式可以是有氧运动、力量锻炼或柔韧性训练,包括快走、慢跑、跳绳、游泳、杠铃、沙袋等。每天坚持锻炼至少30 min,最好达到60 min的中等强度运动。每周至少完成中等强度运动5 d,才可起到控制体重的作用。
4.药物治疗:(1)起始的药物治疗可以为单一的二甲双胍或胰岛素,或者两者联合使用。(2)如果存在糖尿病症状、严重高血糖,存在酮症或DKA则需要胰岛素治疗。(3)每天1次中效胰岛素或基础胰岛素类似物(0.1~0.2 U·kg-1·d-1)即有效。如果没有酸中毒,可以联用二甲双胍。待代谢稳定后,可以在2~6周左右安全过渡到单一的二甲双胍治疗。(4)代谢稳定的患儿(HbA1c<8.5%且无症状)可先用二甲双胍治疗,而代谢不稳定者则需要胰岛素治疗。(5)二甲双胍剂量从500 mg/d开始,每周增加500 mg,3~4周增加到1 500~2 000 mg/d,每天分2次口服。(6)二甲双胍使用3~4个月后,HbA1c仍不能<6.5%,强烈推荐加用基础胰岛素。(7)如果二甲双胍联合基础胰岛素(剂量达到0.5 U/kg)血糖仍不能达标,则需要加用餐时胰岛素。(8)2019年美国食品药品监督管理局批准利拉鲁肽用于治疗儿童和青少年T2DM[
5.血糖监测:T2DM患儿也需要进行自我血糖监测(SMBG)。频率应根据血糖控制状况个体化,主要测量空腹和餐后血糖。一旦血糖达标可根据治疗方案、强化程度及代谢控制水平调整监测次数。每年至少测2次HbA1c,如果使用胰岛素治疗或血糖控制未达标,则每3个月测定1次。
6.控制目标:保持正常生长发育,减轻体重,在避免低血糖的前提下,口服药物治疗者HbA1c尽可能控制在7.0%以下,胰岛素治疗者的控制目标可适当放宽。
1.对老年糖尿病患者应该进行包括基本健康状态、心理、功能(自我管理能力)等在内的综合评估,并以此为框架决定糖尿病管理的目标和路径。(B)
2.对老年糖尿病患者应该进行老年综合征(如多重用药、认知功能减退、抑郁状态、尿失禁、跌倒及持续性疼痛)的筛查。存在上述问题可能会影响老年糖尿病患者的自我管理能力,导致生活质量下降。(B)
3.对65岁以上的老年糖尿病患者在初诊时以及以后每年的随访中应进行轻度认知功能减退或痴呆的早期筛查。(B)
4.老年糖尿病患者有更高的ASCVD危险因素聚集,易于同时存在多种并发症、合并症,各脏器功能减退,老年综合征和骨折的风险增加。应重视包括全身健康状态在内的综合评估及综合管理。(A)
老年糖尿病是指年龄≥60岁(世界卫生组织标准≥65岁),包括60岁以前诊断和60岁以后诊断的糖尿病患者,具有患病率高、起病隐匿、异质性大、危害大等特点。根据2019年国家统计局发布的数字,截至2018年末,我国60岁及以上老年人口达2.49亿,占总人口的17.9%;65岁以上人口1.67亿,占11.9%。老年人群糖尿病的患病率高。2007至2008年我国流行病学调查数据显示,老年糖尿病的患病率为20.4%[4]。2010年该数字升至22.86%[5],另有数量相近的糖耐量减低(IGT)人群。老年人群是糖尿病防治的重点对象,老年糖尿病的治疗目标是减少急慢性并发症导致的伤残和死亡,改善生存质量,提高预期寿命。
1. T2DM是老年糖尿病的主要类型。
2.老年糖尿病患者异质性大,其患病年龄、病程、身体基础健康状况、各脏器和系统功能、并发症与合并症、合并用药情况、经济状况及医疗支持、治疗意愿、预期寿命等差异较大[
3. 60岁以前诊断的老年糖尿病患者糖尿病病程较长,合并糖尿病慢性并发症及合并症的比例高。60岁以后的新发糖尿病患者症状多不典型,血糖相对易于控制,糖尿病并发症的比例相对较低,但合并多代谢异常及脏器功能受损的情况多见[
4.随着年龄的增长,老年糖尿病患者日常生活能力下降,听力、视力、认知能力、自我管理能力降低,运动能力及耐力下降,加之肌少症、骨量丢失及平衡能力下降,更容易出现运动伤、跌倒及骨折[
5.老年糖尿病患者急性并发症症状不典型,易于误诊或漏诊。
6.老年糖尿病患者发生低血糖的风险增加且对低血糖的耐受性差,更容易发生无意识低血糖、夜间低血糖和严重低血糖,出现严重不良后果[
7.老年糖尿病患者常伴有动脉粥样硬化性心血管疾病(ASCVD)危险因素的聚集,如肥胖、血脂异常、高血压、高尿酸血症、高凝状态、高同型半胱氨酸血症等,心、脑、下肢血管等大血管病变的患病率高[
8.老年糖尿病患者易合并肿瘤、呼吸、消化系统等疾病。
9.老年糖尿病患者常多病共存,需要服用多种治疗药物,需要关注和了解药物间的相互作用和影响,避免不合理用药[
1.急性并发症:包括HHS、DKA及乳酸酸中毒。部分老年糖尿病患者以HHS为首发症状。DKA多因停用胰岛素或感染、外伤等应激情况诱发。乳酸酸中毒常见于严重缺氧及肾功能不全的患者。血糖、渗透压、酮体、血气分析及乳酸检测有助于鉴别诊断。老年糖尿病急性并发症死亡率较高,需要及时启动胰岛素治疗。
2.慢性并发症:糖尿病大血管病变以动脉粥样硬化为基本病理改变,主要包括心、脑及下肢血管病变,其主要特点为:虽然症状相对较轻或缺如,但病变范围广泛且严重,治疗困难、预后差,是老年糖尿病伤残和死亡的主要原因。随着增龄及糖尿病病程增加,微血管病变患病率逐渐增高。糖尿病视网膜病变常见,但因多伴有白内障使实际诊断率下降。老年糖尿病肾损害是多种危险因素共同作用的结果,血肌酐水平不能准确反映肾功能状态,需要计算估算的肾小球滤过率(eGFR)。老年糖尿病患者神经系统损害常见,包括中枢神经系统病变和周围神经病变。
3.低血糖:年龄是发生严重低血糖的独立危险因素。老年糖尿病患者发生低血糖的风险增加,加之感知低血糖的能力和低血糖后的自我调节和应对能力减弱,更容易发生无意识低血糖、夜间低血糖和严重低血糖,出现临床不良后果(如诱发心脑血管事件、加重认知障碍)甚至死亡[
4.老年综合征:老年糖尿病患者易于出现包括跌倒、痴呆、尿失禁、谵妄、晕厥、抑郁症、疼痛、睡眠障碍、药物滥用、帕金森综合征、压疮、便秘、营养不良、听力障碍和衰弱综合征等在内的老年综合征,严重影响患者的生活质量和预期寿命,增加了糖尿病管理的难度[
5.老年糖尿病患者骨折风险升高,大幅度增加了医疗费用[
6.老年糖尿病患者抑郁症的发生率明显增加,建议对65岁以上的糖尿病患者每年进行1次筛查,并予以相应处理[
7.老年糖尿病患者痴呆的发生率明显增加,建议对65岁以上的糖尿病患者初诊时及以后的随诊中每年进行1次认知功能的筛查[
综合评估老年糖尿病患者的健康状况是确定个体化血糖控制目标和治疗策略的基础,并以此为框架决定糖尿病管理的治疗目标和路径,血脂、血压也是如此[
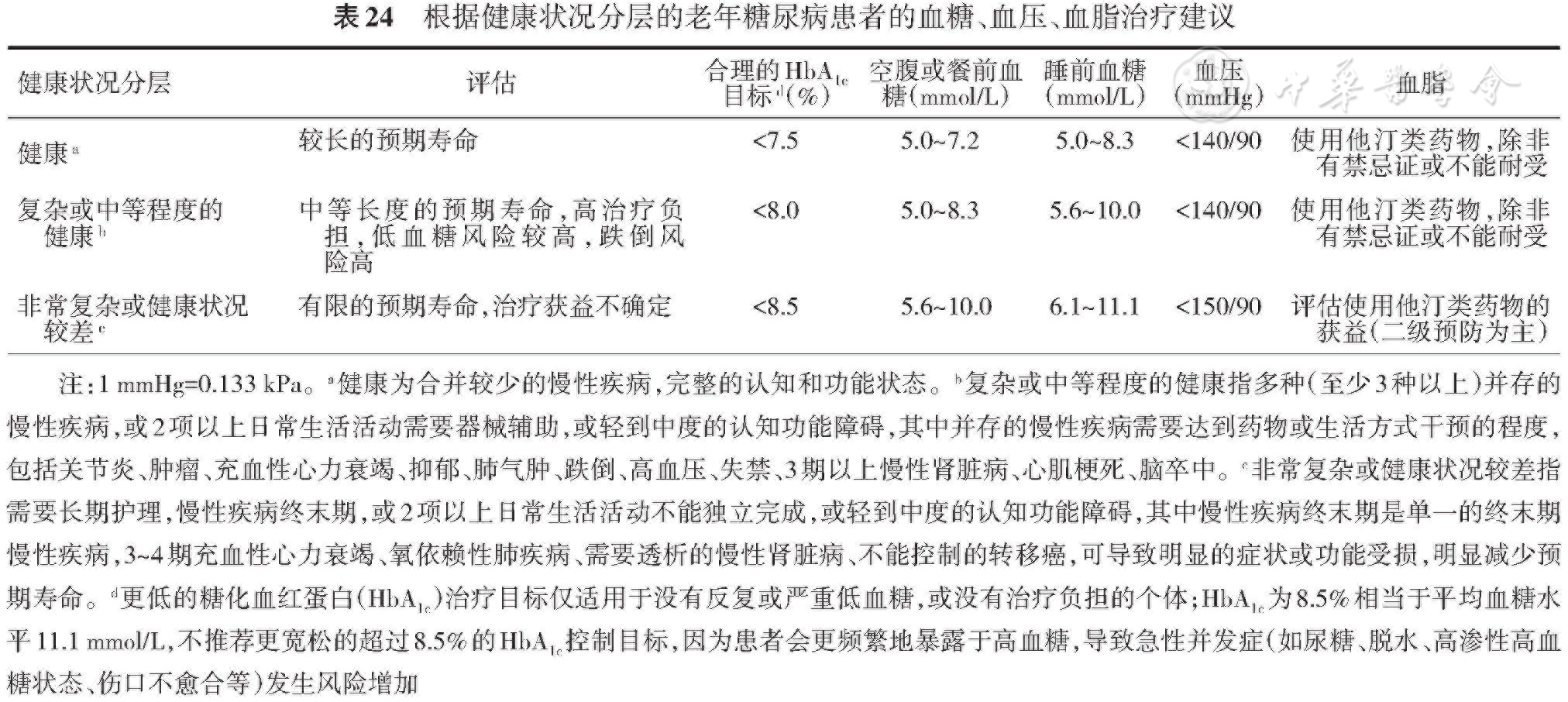
老年糖尿病患者应该在安全前提下进行有效的降糖治疗。健康教育、合理饮食、安全有效的运动应该贯穿老年糖尿病治疗的全程。根据患者的降糖目标、现有血糖情况、重要脏器功能和经济承受能力等因素制定合理、便利、可行的降糖方案。可以优先考虑不易出现低血糖的口服降糖药物,如二甲双胍、α-糖苷酶抑制剂、DPP-4i等[
对患者的人文关怀意味着必须从患者的角度思考医疗行为。老年糖尿病患者的评估和治疗复杂,涉及方方面面的因素,需要全面慎重考虑治疗获益与风险,既要避免因过度强调治疗安全性问题而放松对老年糖尿病的血糖管理,又要避免过度治疗可能出现的问题及带给患者的负担。
1.OSAHS与T2DM风险增加相关,也是糖尿病进展的独立危险因素。(B)
2.T2DM患者合并OSAHS发生率高、知晓率低,建议对T2DM患者进行OSAHS的筛查。(B)
3.对T2DM合并OSAHS患者进行CPAP可以改善胰岛素敏感性,降低空腹、餐后血糖及HbA1c,减少血糖波动。(B)
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是指在睡眠中因上气道阻塞而反复出现呼吸暂停,表现为口鼻腔气流停止而胸腹呼吸存在,是一种累及多系统并造成多器官损害的睡眠呼吸疾病,近年来发病呈上升及年轻化趋势。OSAHS是T2DM常见的共病之一。一方面,OSHAS可导致间歇性缺氧和睡眠碎片化,进而增加交感神经兴奋性、诱发氧化应激、激活炎症通路、造成下丘脑-垂体-肾上腺轴改变,是胰岛β细胞功能受损、胰岛素抵抗、IGT和T2DM的独立危险因素。另一方面,高血糖可抑制颈动脉感受器敏感性,糖尿病控制不佳、糖尿病自主神经病变、糖尿病足是糖尿病人群发生OSAHS的危险因素。糖尿病与OSAHS互相影响,两者严重程度呈正相关[
糖尿病患者中OSAHS的患病率显著高于一般人群。国外资料显示,T2DM患者合并OSAHS的患病率约为55%(24%~86%),发病风险比非T2DM患者高50%[
T2DM患者合并OSAHS发生率高、知晓率低,推荐对有以下症状的糖尿病人群进行OSAHS筛查,包括打鼾、白日嗜睡、肥胖、腹型肥胖、严重胰岛素抵抗、血糖变异度大、多囊卵巢综合征(PCOS)、顽固难治性高血压(以晨起高血压为突出表现)、夜间心绞痛、难以纠正的心律失常、顽固性充血性心力衰竭、反复发生脑血管疾病、癫痫、痴呆、夜尿增多、性功能障碍、性格改变、胃食管反流、不明原因的慢性咳嗽、红细胞增多症和OSAHS家族史等。
1. OSAHS诊断标准[
2.OSAHS的诊断方法:(1)多导睡眠监测(PSG):整夜PSG是确诊OSAHS的金标准,可进行严重程度分级,定量评估睡眠结构、睡眠中呼吸紊乱及低氧情况、心电及血压的变化,识别同时存在的其他睡眠呼吸障碍。(2)便携式睡眠监测设备(HSAT):操作简单易行,可由内分泌科医技人员在门诊或病房进行检查和初步判读。选择设备时应包括鼻压力、胸腹部呼吸感应体积描记及血氧测定等传感器。如HSAT阴性但临床仍怀疑OSAHS,应行PSG检查以明确诊断。(3)新型诊断技术:人工智能系统在OSAHS诊断中与PSG具有较好的符合率,有助于减轻临床压力[
1.生活方式干预:减重对于OSAHS以及糖尿病的治疗都有积极作用,同时能够使其他治疗方式发挥更好的效果。戒烟、酒,戒辛辣刺激食物以免气道水肿、通气不畅加剧。慎用镇静催眠药物以免加重上气道的塌陷和降低呼吸中枢敏感性。白天适当运动避免过度劳累和睡眠剥夺。许多OSAHS是体位依赖性的,侧卧位睡眠和适当抬高床头可在一定程度上降低AHI[
2.药物治疗:目前不推荐药物用于睡眠呼吸暂停本身的治疗。常用降糖药物均可用于OSAHS伴发T2DM患者,但应尽可能使用不增加体重的药物。SGLT2i和GLP-1RA均可降低OSAHS伴发T2DM患者的AHI、体重和HbA1c[
3.改善OSAHS的治疗:持续气道正压通气(CPAP)是OSAHS患者的一线治疗,总体耐受性好,无绝对禁忌证。国内外多项研究结果均显示,CPAP治疗显著改善OSAHS合并T2DM患者的胰岛素抵抗,显著降低HbA1c、空腹及餐后血糖、改善血糖波动[
积极治疗其他导致OSAHS的疾病,如对甲状腺功能减退症所致OSAHS进行甲状腺激素补充治疗。对于上气道阻塞患者可行手术治疗,包括扁桃体和腺样体切除术、鼻中隔偏曲矫正术、鼻息肉切除术、悬雍垂腭咽成形术或正畸手术等。对于同时合并肥胖及OSAHS的糖尿病患者,当BMI≥27.5 kg/m2且AHI≥30次/h可考虑代谢减重手术治疗[
应加强医务人员对两病共存的认识。糖尿病与OSAHS均为复杂异质性疾病且互相影响,应充分考虑患者主诉与感受、疾病的病理生理特点及严重程度,从多方面进行干预和治疗,实现精准治疗。治疗OSAHS有利于改善糖尿病患者的血糖控制,而治疗糖尿病及其并发症(如自主神经病变)也有利于改善OSAHS的病情[
糖尿病容易并发各种感染,细菌感染最为常见,真菌及病毒感染也易发生于血糖控制不佳的糖尿病患者。糖尿病并发感染可形成一个恶性循环,即感染导致难以控制的高血糖,而高血糖进一步加重感染。糖尿病患者手术部位的感染概率大。感染可诱发糖尿病急性并发症,也是糖尿病的重要死因之一。
1.泌尿系统感染:常见,有时可导致严重并发症,如肾盂肾炎、肾及肾周脓肿、肾乳头坏死和败血症。无症状菌尿和其他尿路感染并发症的风险亦增加[
2.呼吸道感染:肺炎常见的致病菌包括葡萄球菌、链球菌及革兰阴性菌。糖尿病是肺炎球菌感染的菌血症高风险人群。毛霉菌病及曲霉病等呼吸道真菌感染亦多见于糖尿病患者。流感病毒、新型冠状病毒也可导致糖尿病患者呼吸道感染[
3.结核:糖尿病患者结核的发生率显著高于非糖尿病患者,并且多见非典型的影像学表现。
4.消化系统感染:糖尿病患者感染幽门螺杆菌[
5.其他感染:皮肤葡萄球菌感染是糖尿病患者的常见感染之一,多见于下肢。足部溃疡的常见致病菌包括葡萄球菌、链球菌、革兰阴性菌及厌氧菌。糖尿病患者牙周炎的发生率增加,易导致牙齿松动,糖尿病合并颌面部感染亦不少见。外耳炎常见,但常被忽略。糖尿病也增加了慢性骨髓炎的感染风险。糖尿病与霉菌性生殖器感染(女性多数为阴道炎,男性多数为龟头炎)的风险增加相关[
1.预防:良好的血糖控制,加强自身卫生及必要的免疫接种在一定程度上可有效预防严重感染的发生。建议2岁以下糖尿病患者接种13价肺炎球菌结合疫苗。建议所有2岁以上糖尿病患者接种23价肺炎球菌多糖疫苗。65岁以上的患者都需接种23价肺炎球菌多糖疫苗[
2.治疗:严格控制血糖为首要措施,胰岛素治疗为首选;进行有效的抗感染治疗,并根据药物敏感试验结果,及时调整抗生素的种类;必要时行外科手术治疗,特别是在糖尿病足病的治疗过程中更为重要。
1.糖尿病可引起或加重牙周病、口腔黏膜病变、龋齿、牙槽骨吸收、牙齿松动脱落、颌骨及颌周感染等各种口腔疾病。(A)
2.处理好口腔疾病有益于糖尿病的控制。(B)
糖尿病与口腔疾病呈相互影响的双向关系[
1.牙龈炎和牙周炎:糖尿病患者牙周组织易发生感染,临床表现为牙龈肿胀充血、水肿、疼痛,牙周部位可发生牙周脓肿、牙周袋形成,并有脓性渗出。
2.口腔黏膜病变:糖尿病患者唾液减少,表现为口腔黏膜干燥,失去透明度,有触痛和烧灼痛,味觉障碍。由于口腔黏膜干燥,自洁能力下降,易受到微生物侵入,临床多见感染性口炎、口腔白色念珠菌病、口腔扁平苔藓[
3.龋齿:糖尿病患者唾液质和量发生改变,自洁能力下降,助长菌斑形成和黏附在牙齿表面上。龋齿在糖尿病患者中普遍存在。
4.牙槽骨吸收和牙齿松动脱落:糖尿病患者龋缘出现肉芽肿及牙周袋形成,牙周袋内可有积脓,随之牙齿周围齿槽骨吸收,导致牙齿松动、脱落。随患者年龄增大,牙槽骨吸收和牙齿松动脱落现象更为普遍。
5.颌骨及颌周感染:口腔颌面部有互相连通的筋膜间隙,上至颅底,下达纵隔,内含疏松结缔组织,抗感染能力低,在发生化脓性炎症时可以迅速蔓延。进展的龋齿根尖炎及齿龈炎极易波及颌骨及颌周软组织。糖尿病患者免疫机能下降致炎症扩展更加严重,出现皮肤红肿、局部剧烈疼痛、张口受限、高热、白细胞计数升高,可诱发DKA。
1.一般治疗:保持口腔环境清洁,去除局部刺激因素,如牙石、不良修复体、用口呼吸、食物嵌塞等。保持口腔卫生有助于减少感染。提倡患者养成良好的卫生习惯,定期进行口腔检查。
2.控制血糖:加强血糖控制,有助于口腔病变的治疗,建议患者进行SMBG。
3.控制感染:因口腔颌面部感染极易扩散,对牙龈炎、颌面部感染等应积极控制,防止炎症进一步蔓延导致病情恶化,可在病原微生物检查的基础上选择合适的抗菌素。
4.切开引流,手术治疗:存在牙周脓肿、急性牙髓炎、口腔颌面部蜂窝织炎的患者,需要切开引流,避免病情加重。其他手术治疗包括拔牙、根管治疗术、牙结扎固定术等[
5.对症、支持治疗。
要点提示:
1.类固醇糖尿病的诊断标准包括空腹血糖≥7.0 mmol/L,随机血糖或OGTT 2 h血糖≥11.1 mmol/L。(A)
2. 既往无糖尿病史者,在起始中等剂量糖皮质激素治疗前3 d,建议监测餐前和餐后血糖;既往有糖尿病病史或糖尿病前期者,即使应用低剂量糖皮质激素,也应密切监测血糖。(C)
3. 胰岛素是类固醇糖尿病治疗的首选药物,同时需要尽可能减少类固醇激素的用量。(C)
4.长期应用糖皮质激素的糖尿病患者,一般血糖控制的目标为:餐前血糖<7.0 mmol/L,餐后血糖<10.0 mmol/L,HbA1c<7.0%。(A)
内源性(库欣综合征)和外源性(糖皮质激素治疗)类固醇激素增多与高血糖,尤其是餐后高血糖密切相关。库欣综合征患者中约有60%~90%出现IGT,约30%~40%伴发类固醇糖尿病[
糖皮质激素可通过多种病理生理学机制损害糖代谢,导致高血糖,干扰血糖控制。糖皮质激素分解蛋白质导致骨骼肌量的丢失,细胞内脂质沉积及循环游离脂肪酸增高,以上因素干扰葡萄糖的利用,造成胰岛素抵抗[
类固醇糖尿病属于特殊类型糖尿病[
类固醇糖尿病确诊后应首先进行糖尿病教育。生活方式干预包括饮食和运动治疗,应根据患者的具体情况制定个体化方案[77]。对于所有外源性糖皮质激素应用者,应在病情控制的前提下尽量采用最小有效剂量[
1.非胰岛素类药物治疗:非胰岛素类药物对糖皮质激素所致高血糖的降糖效果尚缺乏大规模随机对照试验,建议临床需在严密监测下使用。对于血糖轻度或中度升高(随机血糖11.1 mmol/L以下)的患者,可使用非胰岛素降糖药。对于短期应用糖皮质激素引起血糖轻度升高者,其口服降糖药物宜选择起效迅速和降低餐后血糖为主的药物。
2.胰岛素治疗:胰岛素为类固醇糖尿病的首选降糖药物[58,
1.临床特点:与普通人群相比,T2DM人群中抑郁焦虑患者更为常见,糖尿病患者抑郁焦虑的风险是正常人群的2倍。约1/4的T2DM或T1DM患者存在不同程度的抑郁状况[
糖尿病患者合并常见的焦虑相关障碍有广泛性焦虑障碍、躯体变形障碍、强迫障碍、特定恐惧症和创伤后应激障碍[
除抑郁焦虑外,一些其他心理行为障碍(如认知障碍[
2.危害:有证据表明,抑郁焦虑等负性情绪可加重糖尿病的病情[
焦虑使糖尿病患者生活和管理复杂化,主要原因有:(1)严重的焦虑表现与低血糖症状有很大重叠,使糖尿病患者难以区分焦虑症状和需要即刻治疗的低血糖症状;(2)确诊糖尿病后对于注射和抽血的焦虑可能会进一步加重或达到特定的焦虑障碍诊断标准;(3)对低血糖的恐惧,可能是糖尿病患者焦虑障碍的来源,会导致患者刻意将血糖水平维持在目标值以上的水平。
3.治疗及管理:心理健康是糖尿病管理中的一部分,尽早发现和缓解糖尿病患者的抑郁焦虑情绪[
对糖尿病伴抑郁焦虑障碍患者的管理内容包括:
(1)心理状态的评估应始终贯穿糖尿病的治疗:抑郁焦虑评估是一种快速、简单的方法,可以帮助患者判断自身的感受是否存在精神心理问题。早期筛查、评估及监测心理状况,尤其是对有抑郁焦虑病史的糖尿病患者,在病情变化(如出现并发症)或存在其他心理社会因素时,应特别注意情绪评估[
(2)心理治疗方法主要包括认知行为疗法,认知部分推动对生活有益的信念;行为方面帮助患者学习采取更为健康的行动。心理治疗尤其是认知行为疗法和协作护理对抑郁焦虑等情绪障碍有效。糖尿病管理团队成员最好有专业的心理治疗师或有经验的精神科医师加盟,以便提供更为专业的心理治疗服务[
(3)当患者有抑郁症、焦虑症、人格障碍、药物成瘾、认知功能障碍等表现时应将其转至具备糖尿病知识的精神科医师就诊[
(4)抗抑郁药物治疗:五羟色胺再摄取抑制剂、五羟色胺和去甲肾上腺素再摄取抑制剂常作为糖尿病合并抑郁焦虑患者的一线选择药物,同时可能改善患者血糖控制。有研究显示,服用抗抑郁药可使糖尿病患者血压得到控制的几率提高95%。但某些抗抑郁药物可能对血糖控制和体重造成不良影响[
研究表明,大约10%的重性精神障碍患者(包括精神分裂症、分裂情感障碍、双向障碍等)共病糖尿病,重性精神疾病患者罹患T2DM的几率是普通人的2~3倍,女性高于男性[
抗精神病药物(尤其是第二代药物)可增加肥胖、T2DM和血脂异常的风险[
研究表明,治疗免疫缺陷病毒(HIV)/获得性免疫缺陷综合征(AIDS)的高活性抗逆转录酶病毒药物也可导致血脂异常和胰岛素抵抗,导致或加重糖尿病,尤其是使用蛋白酶抑制剂时[
除要注意药物交互作用和治疗不良反应等情况外,共病糖尿病的治疗或管理与普通糖尿病类似,包括药物治疗和生活方式干预等方面[
1.优化代谢综合征的防治可预防心血管疾病及T2DM的发生。(A)
2.我国关于代谢综合征的诊断标准为具备以下至少3项:(1)腹型肥胖(即中心型肥胖):腰围男性≥90 cm,女性≥85 cm;(2)高血糖:空腹血糖≥6.1 mmol/L或糖负荷后2 h血糖≥7.8 mmol/L和(或)已确诊为糖尿病并治疗者;(3)高血压:血压≥130/85 mmHg(1 mmHg=0.133 kPa)和(或)已确认为高血压并治疗者;(4)空腹TG≥1.70 mmol/L;(5)空腹HDL-C<l.04 mmol/L。(B)
代谢综合征是一组以肥胖、高血糖(糖尿病或糖调节受损)、血脂异常[高甘油三酯血症和(或)低高密度脂蛋白胆固醇(HDL-C)血症]以及高血压等聚集发病,严重影响机体健康的临床征候群,是一组在代谢上相互关联的危险因素的组合,这些因素直接促进了动脉粥样硬化性心血管疾病(ASCVD)的发生,也增加了发生2型糖尿病(T2DM)的风险。代谢综合征患者是发生心脑血管疾病的高危人群,与非代谢综合征者相比,其罹患心血管疾病和T2DM的风险均显著增加。
我国关于代谢综合征的诊断标准如下[58]:以下具备3项或更多项即可诊断。
(1)腹型肥胖(即中心型肥胖):腰围男性≥90 cm,女性≥85 cm。
(2)高血糖:空腹血糖≥6.1 mmol/L或糖负荷后2 h血糖≥7.8 mmol/L和(或)已确诊为糖尿病并治疗者。
(3)高血压:血压≥130/85 mmHg(1 mmHg=0.133 kPa)和(或)已确认为高血压并治疗者。
(4)空腹甘油三酯(TG)≥1.70 mmol/L。
(5)空腹HDL-C<1.04 mmol/L。
中心型肥胖的腰围切点采用2013年国家卫生和计划生育委员会《中华人民共和国卫生行业标准——成人体重判定》(标准号WS/T428-2013)制定的标准[
目前代谢综合征防治的主要目标是预防临床心血管疾病以及T2DM的发生,对已有心血管疾病者则要预防心血管事件。积极且持久的生活方式治疗是达到上述目标的重要措施。原则上应先启动生活方式治疗,如果不能达到目标,则应针对各个组分采取相应药物治疗。
1.生活方式干预:保持理想的体重、适当运动、改变饮食结构以减少热量摄入、限盐、减少含糖或代糖饮料摄入、戒烟、不过量饮酒和保持良好情绪等,不仅能减轻胰岛素抵抗和高胰岛素血症,也能改善糖耐量和其他心血管疾病危险因素。
2.针对各个组分如糖尿病或糖调节受损、高血压、血脂紊乱以及肥胖等的药物治疗,治疗目标如下:(1)体重在1年内减轻7%~10%,争取达到正常体重指数(BMI)和腰围;(2)血压:糖尿病患者<130/80 mmHg,非糖尿病患者<140/90 mmHg;(3)低密度脂蛋白胆固醇<2.60 mmol/L,TG<1.70 mmol/L,HDL-C>1.04 mmol/L(男)或>1.30 mmol/L(女)[
糖尿病的中医药治疗,遵循辨证论治原则,在协同降糖、改善症状和体征、防治并发症、提高生活质量及三级预防中发挥作用。(B)
中医学将糖尿病归为“消渴病”或“糖络病”等。经典名方如肾气丸[
糖尿病中医辨证方法包括:三消辨证、三型辨证(阴虚燥热、气阴两虚、阴阳两虚)、分类辨证(脾瘅、消瘅)等。病程可分为郁(前期)、热(早期)、虚(中期)、损(晚期)4个自然演变阶段[
1.糖尿病前期气阴两虚证,在生活方式干预的基础上,可联合口服天芪降糖胶囊。
2. 2型糖尿病(T2DM)气阴两虚证,在应用二甲双胍等降糖药物的基础上,可加服津力达颗粒。
3. T2DM早中期:肠道湿热证可口服葛根芩连汤;肝胃郁热证可口服大柴胡汤加减。
4.糖尿病视网膜病变气阴两虚,目络瘀阻证,可口服芪明颗粒。
5.糖尿病周围神经病变气虚络阻证,可口服木丹颗粒,配合针刺、熏洗等治疗改善症状。
6. T2DM常规治疗基础上,可配合针刺协同增效。
1.天芪降糖胶囊:在一项纳入420例糖耐量减低(IGT)患者的REDUCES研究中,该药联合生活方式干预12个月,降低糖尿病发生风险32.1%[
2.金芪降糖片:在一项纳入400例糖尿病前期患者的多中心、随机、双盲、安慰剂对照研究中,服用该药12个月,降低糖尿病发生风险42%[
1.津力达颗粒:在一项纳入192例T2DM患者的多中心、随机、双盲、安慰剂平行对照研究中,服用二甲双胍稳定剂量血糖仍不达标的患者,该药可使血糖进一步下降,提高β细胞功能指数及胰岛素敏感性,并改善口渴、乏力、便秘等症状[
2.天麦消渴片:临床研究和荟萃分析表明,对新诊断的T2DM患者,该药联合常规治疗,降低HbA1c和体重指数(BMI)[
3.参芪降糖颗粒:荟萃分析等研究表明,该药联合常规降糖治疗,降低空腹血糖(FPG)和餐后2 h血糖,改善气阴两虚证相关症状[
4.葛根芩连汤:在一项纳入224例初发T2DM的多中心、随机、双盲、剂量平行对照研究中,该方高、中剂量组治疗3个月,显著降低血糖,改善患者肠道菌群结构及数量[
5.大柴胡汤:在一项纳入480例初发T2DM(肝胃郁热证)的多中心、随机、双盲、安慰剂平行对照研究中,大柴胡汤加减方(糖敏灵丸)干预12周,HbA1c降低1.02%,降低BMI及腰围,改善口苦、咽干、便秘、胸腹满闷等症状[
1.糖尿病肾病:①黄葵胶囊:一项纳入531例T2DM肾病的荟萃分析表明,该药联合常规治疗可降低蛋白尿和血肌酐[
2.糖尿病视网膜病变:①芪明颗粒:临床研究和荟萃分析表明,该药能改善糖尿病视网膜血液循环,减轻缺血损伤和黄斑水肿[
3.糖尿病周围神经病变:木丹颗粒:对糖尿病周围神经病变患者(气虚络阻证),该药改善四肢麻木、疼痛等感觉异常,提高神经传导速度[
1.针刺:一项纳入1 943例T2DM患者的荟萃分析表明,常规治疗联合针刺,可降低血糖、改善体重、提高胰岛素敏感性[
2.中药熏洗:糖尿病周围神经病变,在常规治疗基础上配合活血化瘀等中药熏洗足浴和足部穴位按摩,提高神经传导速度,降低疼痛评分[
作者投稿及专家审稿请登录中华糖尿病杂志官方网站:zhtnbzz.yiigle.com
