糖尿病患者认知功能障碍专家共识
中华糖尿病杂志,第13卷第7期 第678页-第694页
糖尿病和认知功能障碍都是世界范围内普遍流行的慢性疾病。糖尿病患者发生认知功能障碍的风险显著升高,而存在认知功能障碍的糖尿病患者糖尿病自我管理能力下降、糖尿病护理依赖性增加,又加重了糖尿病进展,形成恶性循环。目前已有相当多的糖尿病患者存在认知功能障碍,并且在未来几十年内,糖尿病认知功能障碍患者的人数会不断增加。然而,现阶段医务工作者对糖尿病认知功能障碍的认识相当匮乏,而且也缺少管理和诊治指导意见。中华医学会内分泌学分会组织国内多个相关专业的专家,依据大量国内外糖尿病认知功能障碍临床研究结果并参照管理意见,结合我国实际情况,对糖尿病认知功能障碍的流行病学、定义、危险因素、筛查、诊断、治疗和预防等多个方面进行归纳总结,提供相关指导建议,旨在指导和帮助临床医师对糖尿病患者的认知功能障碍进行规范化综合管理,改善中国糖尿病患者认知功能障碍的临床结局。随着后期临床研究结果的不断增加,本指南还需进行更新和完善。
要点提示:
1.糖尿病患者发生认知功能障碍的风险显著升高。
2.糖尿病认知功能障碍是一种越来越普遍的糖尿病并发症。
流行病学调查结果显示,我国成年人糖尿病的患病率已达11.6%[1]。糖尿病的危害主要表现为各种急、慢性并发症,糖尿病也会显著影响患者的认知功能[2]。糖尿病认知功能障碍作为糖尿病并发症正在逐渐被引起重视。1966年,Reske-Nielsen等[3]对通过16例合并认知功能减退的糖尿病患者进行尸检,发现其脑组织出现严重的灰质、白质弥漫性退行性变,首次提出了“糖尿病脑病”的概念。随后的诸多流行病学研究均显示糖尿病与痴呆,尤其是与阿尔茨海默病(Alzheimer disease,AD)和血管性痴呆(vascular dementia,VaD)存在某些内在联系,如二者的发病均与年龄增长相关,发病高峰年龄类似,均存在一定的遗传倾向等。研究发现,糖尿病与认知功能损害、老化相关的认知衰退和痴呆的风险增加有关[4]。鹿特丹研究(Rotterdam study)发现,2型糖尿病(type 2 diabetes mellitus,T2DM)患者发生痴呆的风险约为正常人的2倍,其相对危险度(relative risk,RR)为1.9,95%可信区间(confidence interval,CI)为1.3~2.8[5]。国内大样本Meta分析同样证实,T2DM患者认知功能障碍的发病风险明显高于正常人,其发生AD、VaD、轻度认知功能障碍(mild cognitive impairment,MCI)的风险分别是非糖尿病者的1.46(95%CI 1.20~1.77)、2.48(95%CI 2.08~2.96)、1.21(95%CI 1.02~1.45)倍[6]。一项随访平均31.7年的纵向人群队列研究证实,糖尿病患者的发病年龄与老年以后发生痴呆的风险显著相关,发病年龄越早的患者发生痴呆的风险越高[7]。糖尿病是公认的导致痴呆发生的危险因素,科学管理糖尿病有助于预防痴呆[8]。2021年美国糖尿病学会(American Diabetes Association,ADA)指南中已明确提及认识糖尿病认知障碍的重要性,指出血糖控制不佳与认知功能下降有关,并且糖尿病持续时间越长,认知功能越差[9]。
要点提示:
1.糖尿病认知功能障碍通常指糖尿病患者伴有认知功能的损伤。
2.根据疾病发生、发展进程或严重程度,糖尿病认知功能障碍主要分为无症状的认知功能减退、MCI和痴呆期三类。
糖尿病认知功能障碍通常指糖尿病患者伴有认知功能的损伤[10]。美国精神病学会《精神疾病诊断与统计手册》第5版中将认知功能分为学习和记忆、语言、执行功能、感知运动功能、复杂注意力和社会认知[11]。认知功能障碍是指上述认知功能中的一项或多项受损,在病程某一阶段常伴有精神、行为和人格异常,认知功能障碍主要包括MCI和痴呆两个阶段。MCI是认知功能处于正常与痴呆间的一种过渡状态。痴呆是一种以获得性认知功能损害为核心,并导致患者日常生活能力、学习能力、工作能力和社会交往能力明显减退的综合征[12]。
根据疾病发生、发展进程或严重程度,可分为无症状的临床前期、MCI期和痴呆期三类[10]。无症状的临床前期仅涉及单个认知域的轻微损害,客观神经心理学评估无明显异常,但已有脑部病理、结构和功能的改变。老年人出现糖尿病认知功能障碍可能为痴呆的早期阶段。MCI指记忆力或其他认知功能出现进行性减退,但不影响日常生活能力,未达到痴呆的诊断标准的一种疾病状态。痴呆时患者的认知功能损害程度足以影响其社会或职业功能,可能伴有精神、行为或人格的异常。
根据发病机制不同,糖尿病引起的痴呆主要分为两种类型。一种是糖尿病相关脑血管损伤引起的认知功能损害,主要为VaD;另一类是指糖尿病引起的神经退行性病变,主要为AD。
要点提示:
1. T2DM人群较非T2DM人群发生痴呆的风险高出2.8倍。
2.糖尿病患者的血糖控制与认知功能之间关系密切。
3. β-淀粉样蛋白沉积和tau蛋白过度磷酸化是AD患者的典型病理特性;对脑脊液进行β-淀粉样蛋白和磷酸化tau蛋白水平的检测有助于AD的诊断。
世界阿尔茨海默病报告(2015年版)显示,目前全球约有5 000万痴呆患者,全世界大约每3秒即新发1例痴呆患者,其中约7%~13%的痴呆与糖尿病相关[13];流行病学证据显示,T2DM人群较非T2DM人群发生痴呆的风险高出2.8倍[14];60岁以上的T2DM患者中,多达20%的人群可能会发展为痴呆[15]。
T2DM患者认知功能减退起病隐匿,主要发生在中老年时期[16]。糖尿病认知功能减退速度较自然衰老人群快约50%。既往的横断面研究显示,T2DM患者中的MCI患病率[17]约为20%~30%,痴呆发病率约为17.3%[18],糖尿病患者发生AD的风险约为同年龄、同性别非糖尿病患者的1.5~2.5倍[19]。糖尿病患者心血管风险行动-记忆亚组(ACCORD-MIND)研究表明,糖化血红蛋白(glycated hemoglobin A1c,HbA1c)每增加1%,数字符号替换测验(digit symbol substitution test,DSST)得分显著降低1.75分,简易精神状态检测表(mini mental status examination,MMSE)得分降低0.20分,雷伊听觉语言学习测验(Rey auditory verbal learning test,RAVLT)的记忆分数降低0.11分,而斯特鲁普色词测验(Stroop)延迟至0.75 s以上[20]。因此,糖尿病患者的血糖控制与认知功能的变化关系密切。爱丁堡2型糖尿病研究发现,大多数的认知功能指标与视网膜病变的严重程度密切相关;中重度视网膜病变的受试者糖尿病患病病程更长,血糖控制更差以及认知障碍更为严重[21]。糖尿病患者发生AD的速度明显加快。正常患者从MCI进展为痴呆的中位时间为5.01年(95%CI 5.15~6.19),糖尿病或糖尿病前期患者从MCI进展为痴呆的中位时间为1.83年(95%CI 2.44~4.24),因此,糖尿病或糖尿病前期使MCI向痴呆的进展平均加快了3.18年[22]。早期发现MCI并采取有效的干预措施,是防止和延缓痴呆发生的重要途径[23]。
AD占所有类型痴呆的50%~70%;帕金森病痴呆(Parkinson disease with dementia,PDD)约占痴呆的3.6%;VaD是最常见的非变性病痴呆,占痴呆患者的15%~20%[12]。AD典型的病理特征是β-淀粉样蛋白(amyloid β,Aβ)在大脑皮层和海马区神经细胞外大量沉积形成老年斑,过度磷酸化的tau蛋白聚集于细胞内形成神经原纤维缠结。脑脊液中β-淀粉样蛋白42(β amyloid42,Aβ42)浓度的降低是公认的AD诊断的生物标志物[24]。Sutphen等[25]在人群的纵向研究中发现,脑脊液中Aβ42浓度从中年早期就可能开始减少,并且Aβ42水平随着大脑淀粉样斑块的增加逐渐减低。Wang等[26]发现,脑脊液中Aβ42减少与认知正常老年人情景记忆变差和大脑海马体积减小具有相关性。Olsson等[27]进行的一项荟萃分析发现,AD患者脑脊液总tau蛋白(total tau,T-tau)、过度磷酸化tau蛋白(hyperphosphorylated tau,P-tau)与AD密切相关,较正常人明显升高;脑脊液T-tau和P-tau分别是正常对照组的2.54倍(95%CI 2.44~2.64)和1.88倍(95%CI 1.79~1.97)。线粒体功能障碍在AD进展中也扮演了重要的角色。研究证实,与年龄相仿的正常人相比,AD患者大脑颞叶和顶叶的葡萄糖利用率显著降低[28];在AD大脑中,可以观察到线粒体形态、分裂和分布异常,呼吸链复合物蛋白表达和酶活性降低,ATP产量下降以及活性氧生成增多等[29]。
目前糖尿病认知功能障碍的机制尚未明确,研究表明,胰岛素抵抗在糖尿病认知功能减退发病中起重要作用。胰岛素作用于中枢神经系统,可调节外周代谢、增强全身胰岛素敏感性、抑制内源性葡萄糖生成,还可以调节认知。同时,还有其他一系列假说,包括脑组织结构变化、脑血流量改变、脑细胞代谢异常、胰岛素缺乏和胰岛素信号通路受损、炎症介质增加、免疫失调、线粒体功能障碍等,这些病理生理改变进一步导致了神经细胞结构和功能受损,从而影响认知功能。具体机制尚待进一步探讨。
要点提示:
1.诸多危险因素(主要分为可调控和不可调控危险因素)参与了糖尿病认知功能障碍的发生发展。
2.对可调控危险因素进行早期干预,有助于降低糖尿病认知障碍发病风险。
糖尿病认知功能障碍的危险因素分为不可调控的危险因素和可调控的危险因素。其中不可调控的危险因素包括年龄、性别和遗传因素等;可调控的危险因素包括心脑血管疾病、血压、血脂、T2DM、饮食、吸烟、教育水平和体力脑力活动等[8, 30]。从观察性研究中得到的一致证据显示,全球约35%的痴呆患者是由下列几种常见的可改变危险因素引发的,即糖尿病、高血压、肥胖、中年听力丧失、缺乏锻炼、抑郁和社交孤立、吸烟和受教育程度低[31]。糖尿病、糖尿病前期均与明显的认知能力下降具有相关性[32]。糖尿病特征因素(如慢性高血糖、反复发作的低血糖、血糖波动、微血管并发症)以及糖尿病伴发因素(如肥胖、高血压、血脂紊乱等)也参与了患者认知功能减退的发生发展。
作为T2DM的典型特征,胰岛素抵抗被证实是AD的危险因素[33]。胰岛素抵抗的患者表现出较差的认知功能,包括定向、记忆延迟、注意力和计算区域等认知域[34]。与健康对照组相比,AD患者大脑中胰岛素受体、胰岛素样生长因子-1受体(insulin-like growth factor 1,IGF-1R)和胰岛素受体底物-1重组蛋白(recombinant insulin receptor substrate 1,IRS-1)的表达和激活减少[35],大脑新皮层的胰岛素水平和与胰岛素受体的结合降低[36]。异常Aβ代谢产物可能导致葡萄糖耐受不良和胰岛素抵抗,促进糖尿病发生发展[37];胰岛素代谢异常也会影响到Aβ的合成和分解,加速认知功能损害[38]。
成人思维变化(adult changes in thought,ACT)大型前瞻性队列研究发现,老年人较高的血糖水平会增加痴呆的患病风险。非糖尿病人群中,5年内较高的平均血糖水平与痴呆的风险增加相关。115 mg/dl的血糖水平与100 mg/dl相比,调整后的发生痴呆的风险比为1.18(95%CI 1.04~1.33)。在糖尿病患者中,较高的血糖水平也与老年痴呆风险增加具有更高的相关性。190 mg/dl的血糖水平与160 mg/dl相比,调整后的发生痴呆的风险比为1.40(95%CI 1.12~1.76)[39]。在T2DM患者中持续高血糖环境一方面引起的缺氧代谢加重酸中毒,损害缺氧脑细胞,进而损害中枢神经系统[40];另一方面,晚期糖基化终末产物在T2DM患者中显著积累,并通过多种机制对神经细胞产生毒性,导致认知功能障碍[41]。慢性高血糖亦可诱导tau蛋白过度磷酸化[42]。有研究表明,糖尿病中高血糖状态会使醛糖还原酶活性增高,山梨醇通路激活,引起细胞内高渗与水肿状态,损害神经元细胞的结构与功能,促进认知功能障碍的发生[43]。
低血糖的反复发作会使心脑血管事件的发生风险增加,增加中风和心血管死亡率[44, 45]。与糖尿病相关的严重低血糖发作是进行性认知障碍的重要因素之一。在对1型糖尿病患者的研究中,频繁地发生严重低血糖与认知相关脑损伤有关,并导致后期儿童认知能力下降。在成人T2DM中,低血糖发作后又加速认知能力的下降,而认知能力减退容易导致严重低血糖发作[46]。同样,研究还显示严重低血糖与MCI和痴呆之间有显著的关联[41, 47]。因此,低血糖与认知功能障碍存在双向关系,低血糖可增加痴呆的风险;相反,认知功能的下降也可能导致低血糖发生率的增加。可能的病理生理学假说包括低血糖发作时海马神经元的损伤、炎症过程、凝血缺陷、内皮细胞异常和突触功能障碍[41]。
糖尿病患者的血糖控制与微血管并发症关系密切,能导致糖尿病神经系统病变、糖尿病视网膜病变(diabetes retinopathy,DR)和糖尿病肾脏病变等。Crosby-Nwaobi等[48]发现,DR患者的认知障碍风险比非糖尿病患者高出近3倍,尤其与语言学习和近期记忆等认知领域的损害关联更密切。DR在一定程度上反映了脑部微小血管损伤,DR的加重与更严重的认知能力下降有关,提示脑微血管疾病在促进T2DM患者衰老性认知能力下降方面具有重要作用[21]。也有研究证实,并发糖尿病肾病的T2DM患者认知功能障碍与肾微血管病变呈正相关[49],但相关临床证据较少,还需要后期更多的研究。
脑动脉硬化是糖尿病的主要并发症之一,可出现脑血流动力学改变、慢性脑缺血、低氧和能量代谢障碍,这些病变会引起认知功能的损害。采用颈动脉-股动脉脉冲波速对T2DM患者进行综合神经心理评估,结果显示T2DM患者的注意力和(或)执行功能和处理速度明显较差[50]。
与血压正常的糖尿病患者相比,T2DM合并高血压患者表现出更大的认知变化[51]。除此之外,通过对老年糖尿病患者长达6年研究的logistic分析发现,高密度脂蛋白胆固醇水平的降低和高舒张压与认知能力下降显著相关[52]。因此,控制糖尿病代谢紊乱对维持和延缓认知功能障碍具有重要意义。同时,T2DM患者的认知状态与同型半胱氨酸水平相关,同型半胱氨酸被认为是MCI的独立危险因素[53]。抑郁症在预防痴呆和糖尿病的自我管理中也很重要,是糖尿病患者发生年龄相关性认知功能障碍的独立危险因素[54]。
充分了解并对于以上危险因素进行早期评估和防控,同时积极探寻新的早期诊断靶点,有助于延缓或避免糖尿病认知功能减退的发生,降低远期痴呆发生概率,提高患者生活质量。
对老年糖尿病患者考虑进行医学、功能、心理和社会领域的综合医学评估,以确定治疗目标和治疗方案,帮助患者进行糖尿病的自我管理。具体内容包括:(1)≥65岁的成年人可进行年度神经心理评估筛查,以早期识别MCI或痴呆。对老年糖尿病患者应仔细筛查和监测认知功能障碍,特别是在怀疑存在痴呆时。有几个简单的神经心理评估工具可用于筛选认知障碍,如简易精神状态检测表(mini mental status examination,MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)。(2)当患者由于自我护理活动问题(如胰岛素剂量计算错误、碳水化合物计算困难等)而导致临床状况显著下降时,应考虑进行认知障碍筛查[55]。尽管有研究显示,在使用胰高糖素样肽-1受体激动剂(glucagon-like peptide 1 receptor agonist,GLP-1RA)后,肥胖糖尿病患者的认知和嗅觉异常均得到了改善[56],但是目前并没有将嗅觉功能障碍归为神经病变的一部分。在未来有可能成为预测糖尿病认知功能障碍的风险指标。
推荐1 推荐≥65岁的成年人应在初次就诊时进行MCI或痴呆的早期筛查(如MMSE和MoCA),并酌情每年进行1次。筛查出认知功能障碍的患者应接受适当的诊断评估[55]。同时,当患者由于自我护理活动问题(如胰岛素剂量计算错误、碳水化合物计算困难等)而导致临床状况显著下降时,应考虑进行认知障碍筛查。
要点提示:
1.神经心理学评估是目前评估认知障碍的主要手段之一。
2.影像学检查是评估认知障碍的条件之一。
3.功能影像学检查有助于AD的早期评估。
4.脑脊液生物标志物检查是诊断认知功能障碍的常用方法。血液AD生物标记物检查很有前景,但暂不推荐作为认知功能障碍的常规检查。
认知功能障碍是多因素的,AD和血管疾病是痴呆病因学分类中占比较大的两个方面。不同严重程度、不同阶段的认知功能障碍患者预后及管理方式不同,准确地诊断及鉴别诊断糖尿病认知功能障碍、评估严重程度、阶段等具有重要临床意义。结合神经心理行为学评估、影像学及实验室检查可以分析糖尿病认知功能障碍的特征。
尽管流行病学证据表明糖尿病患者患痴呆和MCI的风险增加,但关于其因果关系仍然存在争论[10]。不同于其他典型的糖尿病终末期器官并发症,没有明确证据表明认知障碍风险的增加可以完全归因于血糖控制[57]。大多数患者可能涉及多种原因,且个体间变异也很明显[10]。目前尚不能区分糖尿病所致的认知障碍与糖尿病合并认知功能障碍。
对糖尿病患者的认知功能障碍评估包括详细的病史询问和检查等项目。如评估为认知障碍低风险,则应每1~2年持续监测;如为高风险,则需行简短的神经心理学测试。若评估提示有较高的认知功能障碍的可能性,需请神经内科专家进一步进行神经心理学评估、实验室和影像学检查等以最终确诊。与此同时,排除并治疗常见的可逆性认知功能障碍也很重要,包括谵妄、药物不良反应、代谢或内分泌异常、睡眠障碍和抑郁症等[15],诊断流程见
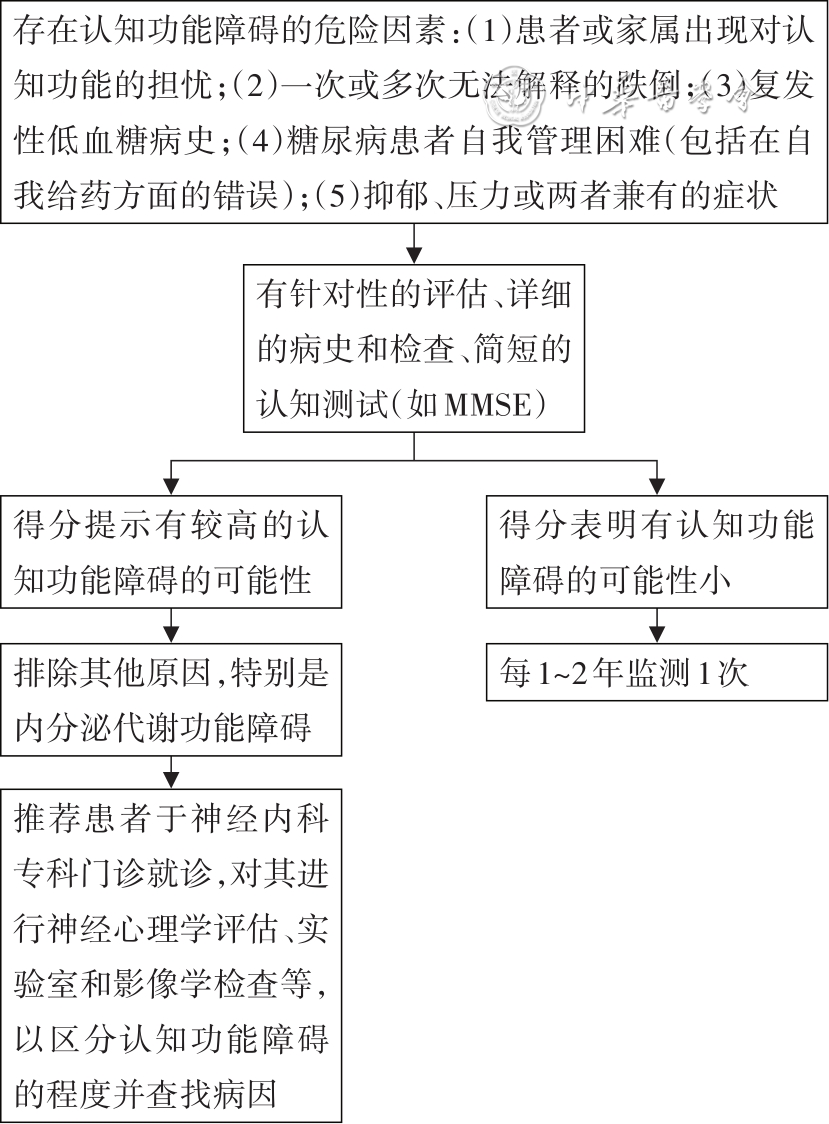
注:MMSE为简易神经状态检测表
对于诊断标准中的整体认知功能、客观记忆能力的临床判断通常应用量表评估其损害程度。神经心理学评估是目前各大指南均推荐的作为诊断认知障碍的主要手段。临床常用的诊断评估工具如下。
1.MMSE:侧重于筛查整体认知功能(时间、地点定向力、计算力、记忆力、语言能力、注意力和视空间能力),共30个题目,总分值为30分,完成需要5~10 min。在临床和社区调查中作为痴呆初步筛选工具,具有简短、敏感性高的特点,具有广泛的实用性,但该量表的测验成绩与患者文化水平密切相关[58]。
2.MoCA:是用来对MCI进行快速筛查的评定工具,包括了注意与集中、执行功能、记忆、语言、视结构技能、抽象思维、计算和定向力等8个认知领域的11个检查项目。完成MoCA检查大约需要10 min。同MMSE一样,MoCA量表的评分应考虑到患者的文化程度[59]。
3.临床痴呆量表(clinical dementia rating scale,CDR):对痴呆患者认知功能和社会生活功能损害的严重程度进行临床分级。采用临床半定式访谈患者和知情者来获得信息,评估6个类别(记忆力、定向能力、判断和问题解决能力、社交活动能力、家庭和兴趣与个人生活自理能力)中的功能,按严重程度由轻到重依次分为健康、可疑痴呆、轻度痴呆、中度痴呆和重度痴呆,描述了一个连续的、动态变化的过程。每个类别包含5~15个问题,本量表总分值共3.0分,完成需要10 min。通常来说,CDR为0表示无痴呆,CDR为0.5表示非常轻度的痴呆(MCI),CDR为1.0、2.0或3.0对应于轻度、中度或严重的痴呆[60]。CDR的认知障碍评分标准也需将患者的文化水平纳入进行综合考虑。
4.阿尔茨海默病评估量表-认知部分(Alzheimer disease assessment scale-cog,ADAS-cog):主要检测情景记忆,由12个条目组成,覆盖记忆力、定向力、语言、运用、注意力等,可评定AD认知症状的严重程度及治疗变化,常用于轻中度AD的药物疗效评估(通常将改善4分作为临床上药物显效的判断标准),共计12题。但是该量表不适合极轻度和极重度的患者,不能用于诊断和鉴别诊断。
5.听觉词语记忆测试:作为1个独立测试,反映听觉情景记忆,较韦氏成人智力量表简单且耗时相对较短,包括3次即刻自由回忆、延迟自由回忆、线索回忆和再认。该测试是国内外MCI研究常用的记忆力减退的筛查工具。
6.日常生活能力评分(activity of daily living scale,ADL):由躯体生活自理量表和工具性日常生活活动量表组成,主要用于评定日常生活能力。本测验为短程自评量表,操作方便、容易掌握,不受年龄、性别、经济状况等因素影响;应用范围广,适用于各种职业、文化阶层及年龄段的正常人或各类精神疾病患者。ADL共有14项,包括两部分内容。一部分是躯体生活自理量表,共6项,具体包括上厕所、进食、穿衣、梳洗、行走和洗澡;另一部分是工具性日常生活能力量表,共8项,包括打电话、购物、备餐、做家务、洗衣、使用交通工具、服药和自理经济。评定结果可按总分、分量表分和单项分进行分析。总分量<16分为完全正常;≥16分提示不同程度的功能下降。单项分1分为正常,2~4分为功能下降。凡有2项或2项以上评分≥3分,或总分≥22分,为功能有明显障碍。
7.认知能力筛查量表(cognitive abilities screening instrument,CASI):CASI是一套筛查痴呆的认知功能检查量表,由MMSE发展而来,即可以同时得到MMSE得分,其优于MMSE之处在于有助于AD严重程度的判断和不同类型痴呆的鉴别诊断。能对注意、旧记忆、新记忆、心算、计算力、言语流畅性、语言能力、构图能力、概念判断力在15~20 min内做出定量评价。CASI作为痴呆筛查测验已得到公认,但是否可以在社区大样本筛查还未知,且目前其划界分无公认的数值,文化程度不同的受试者其划界分亦不同。其中,CASIC-2.0是一个专为中国人编制的认知功能筛检量表,且适用于低文化人群,符合我国老年人群文化程度低的国情。周燕等[61]研究得出,该量表识别MCI的敏感度为70.6%,识别轻度AD的敏感度为82.7%,特异度为73.9%。但是对于大学及以上文化者,CASI难度过低,容易出现假阴性。所以,CASI对MCI的识别有一定的辅助作用,可有效判断AD患者认知损害的严重程度[62]。
目前对于以上各种量表的应用中应该注意:(1)测查时,应保持环境安静,减少干扰,测试人员应语音清晰,语调和缓,鼓励患者积极回答;(2)量表只侧重于痴呆的某一方面或者几方面;(3)认知评估结果需要结合患者的文化水平和生活背景综合解释,不能代替临床医师的思维和判断;(4)测试人员应进行相关培训,客观熟练使用量表评估[63]。
推荐2 推荐MMSE用于痴呆的筛查。
推荐3 推荐MoCA用于MCI的筛查。
推荐4 推荐将ADAS-cog用于轻中度AD药物疗效评价;推荐CDR用于痴呆严重程度的分级评定和随访;推荐ADL用于评估患者的日常生活能力。
糖尿病患者认知功能相关的脑影像学变化主要包括脑实质与脑血管改变、纤维连接重塑及脑区激活程度改变、脑代谢改变等。影像学检查是评估认知障碍的条件之一。
头颅MRI有助于明确认知功能障碍的病因。在对AD神经成像计划数据库的811名受试者中进行了T1加权结构MRI评估后发现,T1加权MRI诊断AD的受试者工作特性曲线下面积为96.95%[64],表明三维T1加权像对AD诊断性能良好。如无三维T1加权像,可行冠状面T1加权像替代。通过MRI可以显示内侧颞叶的萎缩(海马、内嗅皮质、杏仁核体积缩小)。扩散加权成像(diffusion-weighted imaging,DWI)和T1增强可以用于炎症、肿瘤导致痴呆患者的诊断和鉴别,如DWI显示血管性痴呆患者的新发梗死灶。
1.脑实质与脑血管改变:(1)脑容量改变:糖尿病前期即可出现脑部体积改变,1型糖尿病患者局部灰质减少,T2DM患者广泛性脑萎缩且集中于脑室周围。(2)白质高信号:脑白质缺血性脱髓鞘改变,与注意力、执行功能等相关,加速认知衰退。糖尿病患者白质高信号略有上升,但各研究存在异质性。(3)脑梗死病灶:T2DM患者脑梗死风险增加1.3~2.2倍,尤其在老年人中腔隙性脑梗死多发。(4)小血管病变:脑内微血管局部缺血或微出血,糖尿病患者较对照组增多。
2.功能改变:(1)扩散张量成像:反映纤维功能连接与信息传递速度降低有关。(2)功能磁共振成像(functional magnetic resonance imaging,fMRI):反映各区域脑神经细胞激活或抑制强弱。研究存在异质性,但糖尿病患者的大脑存在广泛的活性降低。
AD患者早期即出现大脑局部血流及代谢活动的改变,后期才出现结构的变化,功能影像学检查有助于AD的早期诊断。功能影像学检查包括单光子发射计算机体层成像(single-photon-emission computed tomography,SPECT)和正电子发射计算机体层成像(positron emission tomography,PET)。SPECT和PET主要用于对结构影像学难以鉴别的病灶进行诊断,可以增加临床诊断及结构影像的特异度。SPECT和PET相比各有特点,PET因为分辨率高而有更高的敏感度。
1.SPECT:可通过检测脑组织对亲脂性示踪剂如99mTc-六甲基丙烯胺肟(99mTc-HMPAO-HMPAO)或N-异丙基-P-碘苯丙氨的摄取情况来评价相对脑血流灌注量。在一项临床试验中,灌注SPECT扫描阳性可以将AD诊断率提高到92%,而SPECT扫描阴性使诊断率降低到70%。当临床诊断为疑似AD时SPECT检查可提高诊断准确性,SPECT阳性诊断AD概率为84%,SPECT阴性诊断AD概率为52%[65]。
2.PET:(1)葡萄糖代谢显像:2-氟-2-脱氧-D-葡萄糖(18F-FDG)是目前最常用于探测人体内葡萄糖代谢的示踪剂。FDG对于鉴别正常人与AD的准确性为93%,敏感度为96%,特异度为90%[66]。临床结合PET显像可以提高诊断的准确性,FDG-PET显像敏感度和特异度要高于SPECT,可以发现海马、杏仁核及颞顶叶皮质代谢降低。(2)Aβ-PET和tau-PET显像:Aβ淀粉样物质显像的标志物可分为以11C标记和18F标记两类示踪剂,能够特异性与β淀粉样斑块结合。Aβ-PET示踪剂滞留增加能够发现海马、杏仁核及皮质异常Aβ蛋白沉积,可以有效区分AD与额颞叶痴呆,但与痴呆严重程度的关联较弱,而tau-PET显像中的P-tau最初局限于内侧颞叶,随着疾病的进展逐渐向新皮质扩散,与脑组织的萎缩相匹配[67]。
推荐5 MRI是诊断和鉴别诊断痴呆的常规检查;对痴呆患者进行随访检查,MRI有助于判别疾病预后[68]。功能影像不作为痴呆常规诊断检查,但对临床可疑患者可选用SPECT和PET检查以提高诊断的准确率。
CSF检查是诊断认知功能障碍的常用方法。为了准确诊断AD,在结合其他评估的基础上(病史、神经心理学评估和常规影像学检查排除继发性原因),至少应分析4种CSF生物标志物,分别为Aβ42、β-淀粉样蛋白42/40比值(amyloid 42/amyloid 40 ratio,Aβ42/Aβ40)、T-tau、tau蛋白上181位点的磷酸化水平(phosphorylated site 181 ontau protein,P-tau181)[68]。在散发性AD患者中,CSF Aβ42水平明显下降[69];在MCI患者中,通过检测CSF Aβ42诊断AD的平均特异度是64%,敏感度是81%[70]。CSF Aβ42/Aβ40比值相较于Aβ42降低能更显著地反映AD的病理变化[71]。CSF Aβ42/Aβ40比值用于诊断AD的敏感度为64%~88%,而特异度为70%~78%[70]。
脑脊液Tau蛋白的增多反映了AD患者大脑中轴索退行性变和神经纤维缠结的改变,释放了相关Tau蛋白至CSF中[72]。在AD患者中,CSF中T-tau的含量显著增加约300%,其敏感度和特异度达到80%~90%[73, 74],T-tau是从整体上反映了大脑皮质轴索的损害,在卒中、脑创伤等患者中也可见。相比于T-tau,CSF P-tau的升高更能反映AD的病理生理改变,P-tau水平升高特异地提示脑内有神经原纤维缠结形成。P-tau181可以用来鉴别AD与VaD和抑郁等[75]。由于AD源性MCI初期患者脑脊液P-tau显著增高,因而P-tau可以作为该类疾病的早期标志物[76]。在T2DM患者的脑脊液中,可发现磷酸化tau蛋白较健康对照组明显增加[77]。
近期血浆内AD标志物在诊断和预测AD中显示出了良好效能,有望在未来通过血液检测快速诊断AD。
1.血浆P-tau181:研究发现,血浆中P-tau181与脑脊液中P-tau181、tau-PET均呈显著正相关。Janelidze等[78]在长达8年时间的随访中发现,血浆中P-tau181可以预测认知功能正常或MCI人群未来AD的进展,在认知功能正常及MCI中,基线血浆P-tau181高的人群进展为AD的风险高。Karikari等[79]在一项由4个不同队列(1个发现队列、2个验证队列以及1个初级保健队列)组成的大型研究中发现,血浆中P-tau181在区分AD与其他神经变性病变时显示出较高的鉴别诊断能力,包括Aβ阴性的年轻人(曲线下面积为99.40%)、认知未受损伤的老年人(不同队列曲线下面积在90.21%~98.24%之间波动)、其他神经退行性疾病,如额颞叶痴呆(不同队列曲线下面积在82.76%~100.00%之间波动)、血管性痴呆(曲线下面积为92.13%)等。
2.血浆P-tau217:Palmqvist等[80]在一项由3个不同队列组成的总人数为1 402人的大型研究中发现,P-tau217对于AD具有良好的诊断和鉴别诊断效能。在队列1(平均年龄为83.5岁,女性约占38%)中证实,P-tau217在区分AD和非AD时,曲线下面积为0.89(95%CI 0.81~0.97),其准确性明显高于血浆P-tau181和神经丝轻链(曲线下面积0.50~0.72);在队列2(平均年龄为69.1岁,女性约占51%)中证实,血浆P-tau217在区分AD与其他神经退行性疾病(曲线下面积为0.96,95%CI 0.93~0.98),其准确性显著高于血浆P-tau181、神经丝轻链和MRI测量,不劣于tau-PET、脑脊液P-tau217、脑脊液P-tau181;在队列3(平均年龄为35.8岁,女性约占57%)中,早老素1基因突变携带者的血浆P-tau217水平显著高于非携带者,能比突变携带者预计的MCI发病时间早20年。
3.血浆中神经元来源外泌体标志物(neuronal-derived exosome,NDE):一个包含两阶段的多中心研究证实,NDE与CSF中AD核心标志物Aβ42、T-tau及P-tau181具有高度一致性,在区分AD、MCI及正常对照中显示出高效能[81]。
除了年龄,AD最为明确的危险因素是遗传因素,目前已知家族性AD的致病基因主要为早老素1基因、早老素2基因和淀粉样前体蛋白基因。在具有明确家族史的痴呆患者或早老性痴呆患者中对相关致病基因进行筛查有助于提高检出率[68]。
目前关于AD的诊断,有3个国际指南,分别为1984年阿尔茨海默病及相关疾病协会(National Institute of Neurological and Communicative Disorders and Stroke-Alzheimer Disease and Related Disorders Association,NINCDS-ADRDA)指南、2011年美国国立老化研究所和阿尔茨海默病协会(National Institute on Aging-Alzheimer Association,NIA-AA)指南、2014年国际工作组(International Working Group,IWG)指南。
NINCDS-ADRDA指南的诊断依据为[82]:(1)根据临床症状建立痴呆诊断,通过MMSE、Blessed的痴呆量表或其他类似工具等神经心理测试验证;(2)有2项或2项以上的认知功能缺损;(3)记忆和其他认知功能进行性衰退;(4)无意识障碍;(5)在40~90岁之间发病,多在65岁以后;(6)不存在可导致记忆和认知进行性衰退的其他躯体疾病或其他脑部疾病。
NIA-AA指南在NINCDS-ADRDA指南上增加了影像学证据及CSF异常生物学标志物作为诊断依据[83]:(1)将AD视为一个包括MCI在内的连续的疾病过程,即将AD分为临床前AD、由AD引起的MCI和AD引起的痴呆3个阶段;(2)符合AD痴呆临床核心标准,再用生物学标记物进行病因诊断,以提高诊断的准确性;(3)下列任一检查结果阳性:MRI显示内侧颞叶萎缩(海马、内嗅皮质、杏仁核体积缩小)、脑脊液异常生物学标记物(Aβ42下降、Aβ42/Aβ40比值下降或P-tau升高)、分子影像学PET特异图像(FDG-PET表现为海马、杏仁核及颞顶叶皮质代谢减少;匹兹堡化合物B-PET表现为海马、杏仁核及皮质异常Aβ蛋白沉积)、直系家属中证实的AD常染色体显性突变。
IWG指南与NIA-AA指南的不同之处在于,该指南对AD的诊断更加简化,只需通过AD临床表型(典型/非典型)联合AD病理相一致的病理生理生物标志物即可诊断[84]:(1)特异性临床表型早期、显著的情景记忆损害,具有以下特征:①患者或知情者报告的逐渐进展的记忆功能损害超过6个月;②海马型遗忘综合征的客观证据。(2)AD病理改变的证据(下列之一):①CSF中Aβ42水平降低,并且T-tau或P-tau水平增高;②Aβ-PET示踪剂滞留增加;③AD常染色体显性遗传突变(早老素1基因、早老素2基因或淀粉样前体蛋白)。符合A+B即可诊断典型AD。
临床AD诊断可依据1984年NINCDS-ADRDA或2011版NIA-AA提出的AD诊断标准进行诊断[85]。有条件进行AD分子影像检查和脑脊液检测时,可依据2011版NIA-AA或2014版IWG-2诊断标准进行AD诊断[85]。
鉴别诊断中需要指出的是,抑郁症也可以表现为认知功能障碍,痴呆也常合并抑郁,因此,需注意进行鉴别诊断。同时,甲状腺功能减退症、维生素缺乏症、贫血、肾脏或肝脏功能不全等也可能导致认知功能障碍,故需要在对症治疗并在症状好转后,再次评估其认知功能。
推荐6 对于神经心理量表评估后高度可疑AD的糖尿病患者可行脑脊液T-tau、P-tau181和Aβ的检测。血液AD生物标记物具有应用前景,但是目前AD的血液生物标记物暂时未得到公认和批准,故暂不推荐作为痴呆和认知功能障碍的常规检查。
要点提示:
1.维持良好的生活方式有利于降低糖尿病患者认知功能障碍的发生风险。
2.老年人健康状况良好、较少伴有慢性疾病、认知功能状态完好,应该设定较低的血糖控制目标(HbA1c低于7.0%~7.5%);而对于同时患有多种慢性疾病、认知功能障碍的患者,应设定较宽松的血糖控制目标(HbA1c低于8.0%~8.5%)。
3.不同降糖药物对认知功能有不同影响。二甲双胍和GLP-1RA有可能改善认知功能;磺脲类、噻唑烷二酮类、二肽基肽酶Ⅳ抑制剂类、钠-葡萄糖协同转运蛋白2抑制剂类药物对认知功能的影响尚不明确。
4.糖尿病认知功能障碍患者的具体治疗方法与其他非糖尿病认知功能障碍患者相似。值得注意的是,在使用AD治疗药物时,医师应综合糖尿病患者病情进行考虑,而非单独治疗认知功能障碍。
5.早期发现认知功能障碍对糖尿病护理具有重要意义。当临床医师治疗认知功能障碍患者时,关键是简化药物方案,参与支持治疗,加强患者各个方面的护理。
认知功能障碍已经成为老年人群致死和致残的主要疾病之一,而糖尿病人群发生认知障碍的风险显著升高。认知功能障碍致残率高,患者晚期丧失独立生活能力,完全需要他人照料,给社会和家庭带来了沉重的经济负担和护理负担。早期明确和干预认知障碍发病的危险因素、良好的血糖控制、选择合适降糖药物以及对认知障碍的常规治疗等是目前治疗糖尿病认知障碍的主要手段。
控制饮食和运动可能会改善糖尿病认知功能障碍患者与认知功能有关的大脑区域神经元可塑性[86]。芬兰预防老年人认知损伤与认知障碍的干预研究(FINGER)发现,予以老年人如摄入健康饮食、运动、训练记忆能力、管理心血管危险因素等多途径共同干预,出现认知功能下降和记忆问题的风险低于其他老年人群。同时,增加脑力活动(如打牌、阅读、学习新知识等)也能够通过增加认知储备来减低AD的发病风险[87]。与低脂饮食相比,摄入含有橄榄油或坚果的膳食干预似乎能改善认知能力[88]。因此,对于存在早期认知问题的患者,有专家小组建议地中海饮食,即富含水果蔬菜、每周两次鱼、橄榄油、坚果、豆类和粗粮[89, 90]。中年期的规律体力活动可以降低痴呆与AD的发病风险。荟萃分析显示,高强度和中等强度的体力活动可以分别将认知功能减退的风险降低38%和35%[91]。另外一项纳入16项前瞻性研究的荟萃分析显示,活跃的体力活动能够将痴呆的整体发病风险降低28%;而将AD的发病风险降低45%[92]。即便是低强度的体力活动,如散步,也显示出对AD和认知功能减退的保护作用[93]。流行病学资料显示,成年人的系统昼夜节律受损是AD未来发展的重要危险因素[94]。通过将加强早晨光照、白天强制活动、固定的睡眠时间等措施结合起来建立AD患者正常的昼夜模式的整体方法对于治疗AD已经产生了一些令人鼓舞的结果,值得进一步研究[95, 96]。
推荐7 通过饮食控制、运动、增加脑力活动、提倡地中海饮食(如橄榄油、蔬菜、水果、鱼、海鲜和豆类等)、维持良好的生物钟节律等生活方式干预有利于降低糖尿病患者AD发生风险。
血糖控制不良可导致糖尿病认知功能障碍患者住院频率增加,尤其是伴有执行功能损伤者。严格的血糖控制可能增加患者的低血糖发生风险。ACCORD-MIND研究结果显示,为期40个月的干预研究后,强化血糖管理对认知衰退并无裨益[97]。其他研究,如ADVANCE研究等也支持此观点[98, 99]。因此,不建议在有认知功能障碍的患者中进行强化降糖治疗,治疗方案的制定应个体化。对于认知功能障碍的老年患者,临床应注意评估其自我管理能力及治疗依从性,考虑适当放宽血糖控制目标、动态监测高危人群胰岛素水平、进行药物干预等,筛查和管理低血糖事件,避免加重认知损伤。老年患者筛查糖尿病并发症也应该个体化。根据ADA糖尿病诊疗标准,老年人健康状况良好、较少伴有慢性疾病、认知功能状态完好应该设定较低的血糖控制目标(HbA1c低于7.0%~7.5%),而对于同时患有多种慢性疾病、认知功能障碍的患者,应设定较宽松的血糖控制目标(HbA1c低于8.0%~8.5%)[9]。
抗糖尿病药物可改善高血糖、胰岛素抵抗、细胞代谢,并可对抗与胰岛素抵抗状态相关的组织炎症和氧化应激。它们也可能对大脑中的细胞代谢产生积极影响,并改善认知能力。研究显示,吸入式胰岛素可增加脑脊液中的胰岛素浓度从而改善认知状态;二甲双胍和GLP-1RA有可能改善认知功能,降低痴呆的发生风险;磺脲类、噻唑烷二酮类、二肽基肽酶Ⅳ抑制剂(dipeptidyl-peptidase Ⅳ inhibitors,DPP-4i)类、钠-葡萄糖协同转运蛋白2抑制剂(sodium-dependent glucose transporters 2 inhibitors,SGLT2i)对认知功能可能有保护作用,但临床研究证据尚不充分,还需进一步的研究来证实。因此,在适当的条件下,可以考虑优先用以上有益的药物对有认知功能障碍的糖尿病患者进行血糖管理,同时密切关注患者的认知功能变化情况。
1.磺脲类:关于磺脲类药物治疗认知功能障碍的效果目前尚无明确结论。在一项前瞻性队列研究中,二甲双胍和磺脲类药物的联合治疗在8年可降痴呆风险达35%[100]。但是一项人群对照研究结果表明,长期使用磺脲类并不会改变总体上发生AD的风险[101]。未来需要更进一步研究来阐明磺脲类治疗认知功能障碍的获益和相关分子作用机制。
2.二甲双胍:二甲双胍在认知功能障碍中能发挥神经保护作用,尽管确切机制尚不完全清楚。一项针对50岁及以上人群的临床研究表明,与无药物治疗相比,二甲双胍显著降低了痴呆的风险。二甲双胍累积治疗第1阶段(<27.0个月)、第2阶段(27.0~58.1个月)和第3阶段(>58.1个月)发生痴呆的风险比分别为0.975、0.554和0.286[102]。在一项针对老年T2DM受试者的随机双盲试验中,二甲双胍加格列苯脲或罗格列酮治疗显示出工作记忆的显著改善[103]。也有研究报道,在长期服用二甲双胍的患者中痴呆发病率略有增加,考虑与服用二甲双胍导致维生素B12缺乏有关[104]。虽然部分使用二甲双胍治疗认知功能障碍的证据存在争议,但大部分临床试验表明,二甲双胍对于T2DM认知功能障碍的治疗有相当大的潜力。
3.噻唑烷二酮(thiazolidinedione,TZD)类:TZD是否可以改善糖尿病认知功能障碍尚无定论。一项吡格列酮对T2DM合并轻度AD患者的初步研究表明,15~30 mg的吡格列酮治疗6个月,与对照组相比,认知和顶叶脑血流量均有改善[105]。最近对AD患者过氧化物酶体增殖剂激活受体激动剂的Meta分析显示,吡格列酮可能对AD早期发挥轻到中度的改善作用,能够改善MCI患者的认知功能[106, 107]。在一项针对老年T2DM受试者的随机双盲试验中,二甲双胍罗格列酮联合治疗显示出工作记忆的显著改善[103]。另一项基于人群的病例对照研究显示,长期使用TZD一般不会改变AD的发病风险[108]。同时也有研究证实,在为期40个月的治疗之后,与其他治疗组相比,TZD组出现显著的认知状态障碍[109]。
4.GLP-1RA:胰高糖素样肽-1可通过血脑屏障,并且胰高糖素样肽-1受体在包括海马、前额叶、下丘脑、杏仁核在内的与认知相关的中枢神经系统区域有表达,具有神经保护作用。在一项为期26周的随机、双盲、安慰剂对照,平均年龄约66岁丹麦人群中的研究中,与安慰剂组相比,利拉鲁肽改善了MCI和AD患者的葡萄糖代谢和认知功能[110]。REWIND研究是一项为期5.4年,参与者平均年龄大于50岁的随机、双盲安慰剂对照试验,证实了度拉糖肽的长期治疗可能会减少T2DM患者的认知障碍[111]。GLP-1RA在认知功能障碍的治疗中具有很好的应用前景。
5.DPP-4i:DPP-4i与糖尿病认知功能障碍的关系目前仅有动物实验,尚无相关临床研究。
6.SGLT2i:最近有研究表明,恩格列净控制血糖可显著改善T2DM小鼠认知功能下降[112],然而相关证据仍然较少。目前还没有使用这种药物治疗AD的临床试验。
7.鼻内胰岛素治疗:目前国内暂无药物及相关研究。临床证据表明,短期胰岛素治疗对AD患者有保护作用。在无高血糖的高胰岛素血症状态下,成年AD患者的记忆增强,提示该激素在记忆促进方面发挥重要作用。然而,全身注射胰岛素会增加低血糖的风险。为了克服这些问题,在一些研究中已经测试了鼻内注射胰岛素,证明能提高颅内胰岛素水平。一项小型、随机的安慰剂对照试验表明,与对照组相比,早期AD或遗忘型MCI患者21 d内每天2次20 U的鼻内胰岛素治疗可使患者具有更好的语言记忆力。在轻度AD/MCI和载脂蛋白E-4(apolipoprotein E-4,ApoE4)阴性的受试者中,鼻内胰岛素在较低剂量下可改善认知功能。对平均年龄74岁的老年AD/MCI受试者进行对照试验,经鼻胰岛素(20或40 U)治疗的受试者显示出积极效果。鼻内地特胰岛素给药治疗AD和MCI,对患者记忆综合评估后,表现出有显著的积极作用[101]。然而,在另外一项为期12个月的临床试验中,AD或MCI患者接受了40 U鼻滴胰岛素给药治疗后未观察到鼻内胰岛素治疗对认知或功能的获益[113]。
针对普通AD的治疗,目前还没有能有效缓解疾病进展的疗法,现有的治疗基本上都是对症治疗,临床获益有限[114],并且目前没有关于痴呆类药物治疗糖尿病认知功能障碍患者的相关临床试验。乙酰胆碱酯酶抑制剂(cholinesterase inhibitor,ChEI)对痴呆的所有阶段都有一致的益处;美金刚对认知的整体益处较小,仅限于AD中到重度阶段,ChEI和美金刚的联合治疗可能有额外的功效。关于维生素E补充和医疗食品有效性的证据很弱,需考虑到成本、可用性和对个别患者的安全性。针对AD的淀粉样蛋白级联假说的干预并未能证明其有效性,故开发新的AD疗法仍然是一项巨大的挑战[114]。
1.ChEI:ChEI增加突触间隙乙酰胆碱含量,是目前治疗轻中度AD的一线药物,主要包括多奈哌齐、卡巴拉汀、加兰他敏和石杉碱甲。多奈哌齐、卡巴拉汀、加兰他敏治疗轻中度AD在改善认知功能、总体印象和日常生活能力的疗效确切[115, 116, 117]。现有多项研究显示,多奈哌齐、卡巴拉汀对治疗中重度AD也有效果。大样本随机对照试验显示,加兰他敏能显著改善VaD患者的认知、总体功能、日常活动能力和行为[118]。大多数患者对ChEI具有较好耐受性,部分可出现腹泻、恶心、呕吐、食欲下降和眩晕等不良反应。多奈哌齐的不良反应以腹泻最常见[119]。卡巴拉汀最常见不良反应为呕吐,最少见不良反应为眩晕。加兰他敏最常见不良反应为食欲下降,最少见不良反应为眩晕[119]。ChEI治疗存在明确的量效关系,剂量增高疗效增加,但容易出现不良反应。基于10个临床试验进行的荟萃分析发现,对于轻中度AD患者,10 mg/d多奈哌齐治疗组对ADAS-Cog的改善要显著优于5 mg/d治疗组。另一项基于国际219个临床中心进行的多中心随机、双盲对照研究提示,多奈哌齐23 mg/d组可改善较重的AD患者整体认知状况,尤其对语言和视空间功能改善明显。治疗中出现的恶心、呕吐、眩晕等相关不良事件23 mg组略高10 mg组,分别为73.7%和63.7%[120]。卡巴拉汀透皮贴剂和多奈哌齐口崩片改变了给药途径,增加了AD患者服药依从性,在不同程度上降低药物不良反应[121]。因此,明确诊断为AD或VaD患者可以选用ChEI治疗,应用某一ChEI治疗无效或因不良反应不能耐受时,可根据患者病情及出现不良反应程度,调换其他ChEI或换作贴剂进行治疗,治疗过程中严格观察患者可能出现的不良反应。ChEI存在剂量效应关系,中重度AD患者可选用高剂量的ChEI作为治疗药物,但应遵循低起始剂量逐渐滴定的给药原则,并注意药物可能出现的不良反应[85]。
2.美金刚:盐酸美金刚是另一类AD治疗一线药物,是由美国食品药品监督管理局批准的第一个用于中重度痴呆治疗的药物。3项大样本、随机、双盲、安慰剂对照试验证实,美金刚(20 mg/d)治疗中重度AD可改善认知功能、日常生活能力、全面能力及精神行为症状[122]。在治疗中重度AD时,美金刚能选择性改善一些关键认知域障碍如语言、记忆、定向力、行为、视空间能力[123]。基于12项研究的荟萃分析表明,美金刚有助于提高AD患者的认知能力及医师总体印象评分[124]。另一项基于6项多中心、随机、双盲、安慰剂对照研究(为期6个月)的荟萃分析表明,标准剂量的美金刚(20 mg/d)有助于改善中重度AD患者日常生活能力[125]。一项基于队列研究资料的荟萃分析也显示,使用美金刚(10~20 mg/d)24周可显著减缓AD患者从中度向重度的进程,有效防治全面功能和认知功能的衰退[126]。因此,明确诊断为中重度AD或VaD患者可以选用美金刚或美金刚与多奈哌齐、卡巴拉汀联合治疗,对出现明显精神行为症状的重度AD患者,尤其推荐ChEI与美金刚联合使用。必须与患者或知情人充分地讨论治疗益处及其可能出现的不良反应[85]。
3.中药及其他治疗药物:与患者交代治疗益处和可能风险后,可以适当选用银杏叶、脑蛋白水解物、奥拉西坦或吡拉西坦等作为AD患者的协同辅助治疗药物[85]。
总之,目前对于糖尿病伴MCI或痴呆患者尚无特定治疗方案,其治疗方法与单纯MCI或痴呆患者一致。认知功能障碍患者的治疗应控制危险因素(糖尿病、高血压、卒中等)、非药物治疗(身体锻炼、生活行为干预、认知训练)、药物对因治疗(补充叶酸、维生素B12等)、药物对症治疗(ChEI、麦角生物碱、谷氨酸受体拮抗剂)。目前尚无美国食品药品监督管理局推荐的治疗MCI症状的药物,治疗认知功能障碍的药物疗效均有待进一步证实,积极预防或延缓痴呆发生、发展尤为重要。由于糖尿病认知功能障碍患者进展较缓慢,因此多数糖尿病认知功能障碍患者预后较好,尤其是年龄60岁以下者。临床工作中需进一步加强对老年认知保健的宣传,开展广泛的教育,从而进行有效的一级和二级预防。
推荐8 老年人健康状况良好、较少伴有慢性疾病、认知功能状态完好应该设定较低的血糖控制目标(HbA1c低于7.0%~7.5%);而对于同时患有多种慢性疾病、认知功能障碍的患者,应设定较宽松的血糖控制目标(HbA1c低于8.0%~8.5%)[9]。
一旦确诊糖尿病患者存在认知功能障碍,他们的具体治疗方法与其他非糖尿病患者相似。尽管传统AD治疗药物临床效益可能很小,但它们的安全性已经得到评估。值得注意的是,在使用这些药物时,医师应综合糖尿病患者病情进行考虑,而非单独治疗AD[15]。
糖尿病患者出现认知功能障碍时可以选择一些有助于认知功能改善的降糖药物,如二甲双胍(必要时补充维生素B12)、GLP-1RA日制剂(如利拉鲁肽)或周制剂(如度拉糖肽)。其他降糖药物对于认知障碍的作用尚不明确,需要进一步研究和探讨。
尽管缺乏预防或治疗认知功能减退的有效疗法,但早期发现认知功能障碍对糖尿病护理具有重要意义。当临床医师治疗认知功能障碍患者时,关键是简化药物方案,参与支持治疗,加强患者各个方面的护理[9]。
作者投稿及专家审稿请登录中华糖尿病杂志官方网站:zhtnbzz.yiigle.com
